Ⅰ.请按下列要求写出相应粒子的电子排布式,并回答有关问题:
⑴写出基态原子或离子的电子排布式:
①Fe3+_________________; ②Cr _______________; ③Cu _______________.
⑵比较 Fe2+与Fe3+的化学稳定性:Fe2+ Fe3+,半径大小:Fe2+ Fe3+
Ⅱ⑴在第三周期中,第一电离能最小的元素是________,电负性最大的元素是________(用元素符号表示)。
⑵第二、三、周期原子中p轨道半充满的元素是_______ (用元素符号表示)。
⑶第二周期原子中,未成对电子数等于周期系数的原子有 (用元素符号表示)
Ⅲ. (2010·滁州模拟)ClO、ClO、ClO中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构。
| 微粒 | ClO | ClO | ClO |
| 立体结构 |
(14分)Ⅰ. ⑴1s22s22p63s23p63d5、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
⑵Fe2+< Fe3+;Fe2+> Fe3+
Ⅱ①Na;Cl ②N;P ③C;O
Ⅲ.
| 微粒 | 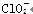 | 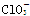 | 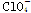 |
| 立体结构 | V形 | 三角锥形 | 正四面体 |
题目分析:Ⅰ.(1)根据构造原理可知Fe3+、Cr、Cu的核外电子排布式分别是1s22s22p63s23p63d5、1s22s22p63s23p63d54s1、1s22s22p63s23p63d104s1。
(2)由于铁离子中3d轨道电子处于半充满状态,稳定性强,所以稳定性是Fe2+< Fe3+;而微粒半径则是Fe2+> Fe3+。
Ⅱ⑴金属性越小第一电离能越小,非金属性越强,电负性越大。所以在第三周期中,第一电离能最小的元素是Na,电负性最大的元素是Cl。
⑵根据元素的核外电子排布式可知,第二、三、周期原子中p轨道半充满的元素是N和P。
⑶同样根据元素的核外电子排布式可知,第二周期原子中,未成对电子数等于周期系数的原子有C和O。
Ⅲ.根据价层电子对互斥理论可知,ClO、ClO、ClO中中心原子氯原子含有的孤对电子对数分别是(7+1-2×2)÷2=2、(7+1-3×2)÷2=1、(7-1-4×2)÷2=0,所以微粒的空间构型分别是V形、三角锥形和正四面体型。
点评:该题是中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是熟练记住构造原理以及价层电子对互斥理论,然后结合题意灵活运用即可,有利于培养学生的逻辑推理和抽象思维能力,提高学生的应试能力和学习效率。
