已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
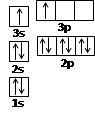
(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了 。
(2)ACl2分子中A的杂化类型为 。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145-140pm,有同学据此认为C60的熔点高于金刚石,你认为此观点是否正确 (填“正确”或“不正确”),并阐述作出判断的理由: 。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质中K原子和C60分子的个数比为 。

(5)C、Si、N原子电负性由大到小的顺序是 ,NCl3分子的VSEPR模型为 。
(每空2分)(1)能量最低原理 (2) sp杂化
(3) 否, C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键
(4) 4s1, 3︰1 (5)N>C>Si,正四面体
题目分析:(1)根据A和B的电离能数据可知,均是第三电离能远大于第二电离能,所以都是第ⅡA族元素。同主族自上而下,金属性逐渐增强,第一电离能逐渐减小,所以A是Be,B是Mg。根据B的核外电子排布如图所示,该同学所画的电子排布图违背能量最低原理。
(2)BeCl2是直线型结构,因此分子中Be的杂化类型为sp杂化。
(3)C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键。而金刚石是原子晶体,熔化时破坏的是共价键。
(4)根据构造原理可知,基态钾原子的价电子排布式为4s1。根据晶胞结构可知,物质中K原子和C60分子的个数分别是12×1/4=3、8×1/8=1,则个数之比为3︰1。
(5)非金属性越强,电负性越大,则C、Si、N原子电负性由大到小的顺序是N>C>Si。NCl3分子中氮原子含有的孤对电子对数是(5-3×1)÷2=1,所以VSEPR模型为正四面体,但实际空间构型是三角锥形。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,试题在注重对基础知识巩固和训练的同时,更侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生逻辑推理能力和空间的想象能力,提高学生灵活运用基础知识解决实际问题的能力,提升学生的学科素养。
