III.阅读(共两节,满分40分)
第一节 阅读理解(共15小题;每小题2分,满分30分)
阅读下列短文,从每题所给的A、B、C和D项中,选出最佳选项,并在答题号上将该项涂黑。
Living an Adventurous Life
Nearly ten years ago, I was told that I had a brain tumor (瘤), and this experience changed my attitude about adventure forever. I thought that I was going to die and that all my adventures were over. I did not have a brain tumor, it turned out, but rather multiple sclerosis (多发性硬化症), which meant that, although they were not over,the nature of my adventures could have to change.
Each morning that I wake up is a fresh event, something that I might not have
had. Each gesture that I make carries the weight of uncertainty and demands significant attention: buttoning my shirt, changing a light bulb, walking down stairs. I might not be able to do it this time. If I could not delight in them, they would likely drown me in anger and in self-pity.
I admire the grand adventures of others. I read about them with interest. With Peter Matthiessen I have hiked across the Himalayas to the Crystal Mountain. I have walked with Annie Dillard up, down, into, and across Tinker Creek in all Seasons. David Bain has gone with me along 110 miles of Philippine coast, and Ed Abbey has
rowed me down the Colorado River, I enjoy the adventures of these courageous figures, who can strike out on difficult trips - 2 miles, 250 miles, 3000 miles - ready to bear cold and tiredness - indeed not just to bear but to celebrate.
But as for me, I can no longer walk very far from the armchair in which I read. Some days I don't even make it to the backyard. And yet I'm unwilling to give up the adventurous life, the difficulty of it, even the pain, the anxiety and fear, aud the sudden brief lift of spirit that makes a hard journey more attractive.
I refine adventure, make it smaller and smaller. And now, whether I am moving on my hands and knees across the dining room to help my cat, lying wide-eyed in the dark battling another period of sadness, gathering flowers from the garden, meeting a friend for lunch, I am always having the adventures that are mine to have.
41. What happens to the author after her illness?
A. She has a fear of medical treatments. B. She travels to places she has dreamed.
C. She can't take care of herself any longer D. She is not drowned in anger and self-pity.
42. Why does the author admire the people mentioned in paragraph 3?
A. Because they write popular novels. B. Because they are great adventurers.
C. Because they are famous geographers. D. Because they struggle with hardship in life
43. The author ends the article with a feeling of______
A. sadness B. sacrifice C. security D. satisfaction
44. What does "adventurous life" in the title mean to the author?
A. The struggles of great people against difficulties.
B. Her concern about giving up certain activities.
C. Her adapting to the situation with an illness.
D. The exciting traveling experience of others.
45. What conclusion can we draw from the passage?
A. Travel can enrich a person's life.
B. Reading is an activity that a patient enjoys most.
C. A positive attitude can improve a difficult situation.
D. A person's ability can be improved through reading.

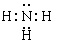 ,三角锥 , sp3
,三角锥 , sp3 。
。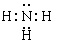 。
。