下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)各元素最高价氧化物的水化物中,酸性最强的是____ ___,碱性最强的是______ _。
(3)写出④与⑤的最高价氧化物对应水化物互相反应的离子方程式__________ _ 。
(4)用电子式表示元素④与⑥形成的化合物:
(5)表示③与①最高价态形成的化合物结构式 ,
(6)写出元素②的最高价氧化物的水化物和它的气态氢化物反应的化学方程式
(7)③、⑥二种元素形成的氢化物沸点较高的是 (用化学式表示),其原因是 。
(共14分)(1)Ar (2分) (2)HClO4 KOH (2分)
(3)OH-+Al(OH)3=AlO2-+2H2O (2分) (4)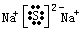 (2分)
(2分)
(5)O=C=O (2分) (6)NH3+HNO3=NH4NO3 (2分)(7)H2O , 水分子间存在氢键 (2分)
题目分析:根据元素周期周期表中的位置可知,①~⑨种元素分别是C、N、O、Na、Al、S、Cl、Ar、K。
(1)根据元素周期律可知,表中元素,化学性质最不活泼的是Ar。
(2)非金属性或金属性越强,最高价氧化物的水化物的酸性或碱性越强,所以最高价氧化物的水化物碱性最强的是KOH,酸性最强的是HClO4。
(3)由于氢氧化铝是两性氢氧化物,所以④与⑤的最高价氧化物对应水化物互相反应的离子方程式是OH-+Al(OH)3=AlO2-+2H2O。
(4)元素④与⑥形成的化合物是硫化钠,含有离子键的离子化合物,电子式是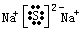 。
。
(5)③与①最高价态形成的化合物是CO2,含有共价键的共价化合物,结构式是O=C=O。
(6)元素②的最高价氧化物的水化物和它的气态氢化物反应的化学方程式NH3+HNO3=NH4NO3。
(7)水分子间存在氢键,沸点高,所以③、⑥二种元素形成的氢化物沸点较高的是H2O。
点评:该题是高考中的常见考点,属于基础性试题的考查。侧重对学生基础知识的巩固与训练,有助于培养学生的逻辑推理能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
