Ⅰ.已知:4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9KJ•mol-1
Fe2O3(s)+
C(s)=3 2
CO2(g)+2Fe(s)△H=+234.1KJ•mol-13 2
C(s)+O2(g)=CO2(g)△H=-393.5KJ•mol-1
写出铝与氧化铁发生铝热反应的热化学方程式______.
Ⅱ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)△H<0体系中,n(NO)随时间的变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)下列研究目的和示意图相符的是______.
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P1>P2) | 温度对反应的影响 | 平衡体系增加O2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 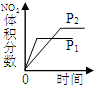 | 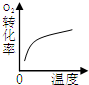 | 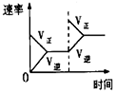 | 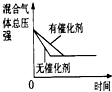 |
(1)电池的负极反应式为______;
(2)放电时固体电解质里的O2-离子向______极移动(填“正”或“负”).
Ⅰ已知:①4Al(s)+3O2(g)=2Al2O3(s)△H=-2834.9KJ•mol-1
②Fe2O3(s)+
C(s)=3 2
CO2(g)+2Fe(s)△H=+234.1KJ•mol-13 2
③C(s)+O2(g)=CO2(g)△H=-393.5KJ•mol-1
由盖斯定律可知,②-③×
+①×3 2
得:2Al(s)+Fe2O3(s)=2Fe(s)+Al2O3(s)1 2
△H=234.1KJ/mol-
×(-393.5KJ/mol)+3 2
×(-2834.9KJ/mol)=-593.1KJ•mol-1;1 2
故答案为:2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s)△H=-593.1KJ•mol-1;
Ⅱ(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,本反应中K=
,0~2s内v(NO)=0.0c2(NO2) c2(NO)•c(O2)
mol/(L•s)=0.003mol/(L•s);v(O2)=0.01-0.004 2
v(NO)=0.0015mol/(L•s);1 2
故答案为:
;0.0015mol/(L•s);c2(NO2) c2(NO)•c(O2)
(2)A、该反应中增大压强平衡向正反应方向移动,则NO2的体积分数增大,与图象不符,故A错误;
B、因该反应是放热反应,升高温度化学平衡向逆反应反应移动,则O2的转化率降低,与图象中转化率增大不符,故B错误;
C、反应平衡后,增大氧气的量,则这一瞬间正反应速率增大,逆反应速率不变,然后正反应速率在不断减小,
逆反应速率不断增大,直到新的平衡,与图象符合,故C正确;
D、因催化剂对化学平衡无影响,但催化剂加快化学反应速率,则有催化剂时达到化学平衡的时间少,与图象不符,故D错误;
故选C;
Ⅲ(1)固体电解质的燃料电池,丙烷燃料电池放电时负极发生的是燃料丙烷失电子的氧化反应,且负极反应=总反应-正极反应,正反应为:
10O2+40e-=20O2-,总反应是:2C3H8+10O2═6CO2+8H2O,所以负极反应是:C3H8+10 O2--20e-=3CO2+4H2O,故答案为:C3H8+10 O2--20e-=3CO2+4H2O;
(2)原电池工作时,阴离子向负极移动,阳离子向正极移动,故答案为:负.
