(17分)CO和H2的混合气体俗称合成气,是一种重要的工业原料气,可以在一定条件下制备甲醇,二甲醚等多种有机物。工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气。
(1) 已知:CH4、H2和CO的燃烧热分别为890.3kJ/mol、285.8kJ/mol和283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ。写出甲烷与水蒸气在高温下反应制取合成气的热化学方程式 。
(2)在一定条件下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
  时间/min 时间/min物质 浓度 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol·L—1 | 0.13 mol·L—1 | 0.1 mol·L—1 | 0.1 mol·L—1 | 0.09 mol·L—1 |
| H2 | 0 mol·L—1 | 0.2 mol·L—1 | 0.3 mol·L—1 | 0.3 mol·L—1 | 0.33 mol·L—1 |
②3min时改变的反应条件是____________________(只填一种条件的改变)
(3)已知温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。
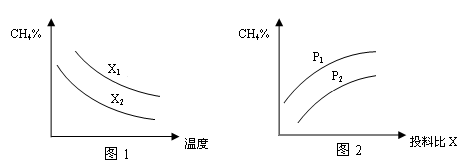
①图1中的两条曲线所示投料比的关系X1____X2(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:p1_______p2
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池
①放电时,正极的电极反应式_______________________________________
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为 ____。
(17分)
(1)CH4(g)+H2O(g)=CO(g)+3H2(g) △H=+206.1kJ/mol(3分,状态或配平或单位或+每少(或错)一项扣1分,最多扣3分;△H数值错了0分。)
(2)①正 (2分),②升高温度或增大H2O的浓度或减小CO的浓度 (2分)
(3)①>;(2分) ②>。(2分)
(4)O2+4e—+2H2O=4OH—(2分,没配平扣1分。)
c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+ ) (4分)
题目分析:(1)已知:①H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1
②CO(g)+1/2O2(g)=CO2(g) )△H=-283.0kJ•mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(l))△H=-890.3kJ•mol-1,
④H2O(g)=H2O(l)△H=-44.0kJ•mol-1,
利用盖斯定律将④+③-②-3×①可得:CH4(g)+H2O(g)=CO(g)+3H2(g),△H=(-44.0kJ•mol-1)+(-890.3kJ•mol-1)-(-283.0kJ•mol-1)-3×(-285.8kJ•mol-1)="+206.1" kJ•mol-1;
(2)①3—4min之间,甲烷的物质的量浓度减少,氢气的物质的量浓度增加,所以化学平衡向正反应方向移动;
②3min时,甲烷、氢气的浓度未变,说明与容器体积无关,而平衡正向移动,所以改变的条件是升高温度或增大H2O的浓度或减小CO的浓度 ;
(3)①根据增大一种反应物的浓度会增大另一种反应物的转化率,本身转化率降低,X1时甲烷的含量高,说明增大了甲烷的浓度,所以X1>X2;
②p1时的甲烷的含量高于p2,压强大对逆反应有利,所以p1>p2
(4)①放电时,正极是氧气发生还原反应,结合电解质溶液,正极反应式为O2+4e—+2H2O=4OH—
②标准状况下氧气的体积为8.96L,物质的量是0.4mol,则转移电子1.6mol,根据CH4~8e-~CO2,可知生成二氧化碳0.2mol,溶液中KOH的物质的量是0.3mol,n(CO2):n(KOH)=2:3,介于1/2-1之间,所以产物既有碳酸钾,又有碳酸氢钾,根据C元素与Na元素守恒,计算K2CO3、KHCO3的物质的量均是0.1mol,溶液中CO32-的水解程度大于HCO3-的水解程度,溶液呈碱性,所以溶液中离子浓度的大小关系是 c(K+)>c (HCO3- )>c (CO32- )>c (OH- )>c( H+ )。
