按要求填空:
(1)写出下列反应的化学方程式:
①镁和水反应 ___________________________________________
②氧化铝和氢氧化钠溶液反应_______________________________________
③硅酸钠溶液露置在空气中变质 __________________________________________
(2)写出表示含有8个质子,10个中子的原子的化学符号: ;
在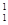 H、
H、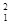 H、
H、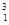 H中共有 种原子,它们能形成 种氢气分子。
H中共有 种原子,它们能形成 种氢气分子。
(3)某简单微粒的结构示意图为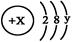 且X、Y 均为不大于20的正整数,据此回答下列问题:
且X、Y 均为不大于20的正整数,据此回答下列问题:
①若呈电中性时该微粒不易与其它物质发生反应,这种微粒的符号是 ;
②若该微粒为负一价阴离子,则x= ,该元素的最高价氧化物的化学式为 。
⑷某元素的最高正价与最低负价的代数和为4,且最高价氧化物中含氧质量分数为60%。则该元素的气态氢化物化学式为 。
(13分)(1) ① Mg+2H2O Mg(OH)2+H2↑;②Al2O3+2NaOH==2NaAlO2+H2O;③Na2SiO3+CO2=Na2CO3+SiO2
Mg(OH)2+H2↑;②Al2O3+2NaOH==2NaAlO2+H2O;③Na2SiO3+CO2=Na2CO3+SiO2
2Na+2H2O==2NaOH+H2( (各2分共6分) (2) 188O;3 ; 6(各1分,共3分)
(3) ①Ar ②17 C12O7 (3分) (4) H2S (1分)
题目分析:(2)核内质子数=其原子序数,所以该元素是8号O元素,质量数为18,所以该原子的化学符号:188O,故答案为:188O。
(3)①该微粒一般情况下不与其它元素的原子反应,说明该原子的最外层达8电子的稳定结构,即y=8,x=18,所以是 Ar,故答案为:Ar;
②该微粒有很强的氧化性,且只需得到一个电子就能达到稳定结构,所以该元素最外层7个电子,即y=7,那么x=17,即Cl元素,最高价氧化物的化学式为C12O7。
⑷元素的最高正价与最低负价的代数和为4以及元素的最高正价与最低负价的绝对值之和为8,所以元素的最高正价为+6,设元素符号为R,相对原子质量为X,则氧化物为R03,最高价氧化物中含氧质量分数为(16×3)/( 16×3+X)×100%=60%,所以X=32,为硫元素,气态氢化物化学式为H2S。
点评:本题考查了核素、同位素、同素异形体的定义及对元素周期表的掌握,侧重考查学生对概念的辨别能力。
单原子离子核内质子数与核外电子数的关系:
1、阳离子的核内质子数=其核外电子数+所带电荷数;
2、阴离子的核内质子数=其核外电子数-所带电荷数
