下表是元素周期表的一部分,列出了十个元素在周期表中的位置:
| 族 周期 | IA | IIA | IIIA | VIA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),
呈两性的氢氧化物是 (填物质化学式);
(3)在⑧与⑨的单质中,氧化性较强的是 (填名称)。
(4)用电子式表示元素③与⑧形成化合物的过程 。
(5)分别写出⑥元素的氢化物:
a.燃烧的化学方程式 ,
b.与氯气在光照条件下反应,生成类似甲烷分子结构(正四面体)的氯代烃的化学方程式: 。
(6)写出工业冶炼⑤的化学方程式:
(7)上述哪些元素可以从海水中通过一定的方法提取: ,(填元素符号)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的化学方程式 ; 。
(1)Na (2)HClO4、 Al(OH)3 (3)氯气
(4)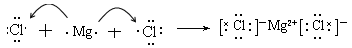
(5)a.CH4+2O2  CO2+2H2O b.CH4+4Cl2
CO2+2H2O b.CH4+4Cl2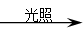 CCl4 + 4HCl
CCl4 + 4HCl
(6)2Al2O3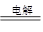 4Al +3O2↑
4Al +3O2↑
(7)K、Na、Cl、Br、Mg ; Cl2+2Br-=2Cl-+Br2 ;Br2+ SO2 +2H2O=H2SO4 +2HBr
题目分析:根据元素在周期表中的物质可知①~⑩分别是Na、K、Mg、Ca、Al、C、O、Cl、Br、Ar。
(1)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则在③~⑦元素中,原子半径最大的是Na。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,则①~⑩中元素最高价氧化物对应的水化物中
酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3。
(3)同主族自上而下,非金属性逐渐减弱,则在⑧与⑨的单质中,氧化性较强的是氯气。
(4)③与⑧形成化合物是氯化镁,含有离子键的离子化合物,则用电子式表示元素③与⑧形成化合物的过程是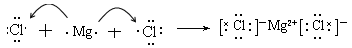 。
。
(5)碳的氢化物是甲烷,燃烧生成CO2和水,反应的方程式是CH4+2O2  CO2+2H2O ;甲烷在光照的条件下,也能和氯气发生取代反应。由于生成类似甲烷分子结构(正四面体),这说明甲烷分子中的氢原子完全被取代,则反应的化学方程式是CH4+4Cl2
CO2+2H2O ;甲烷在光照的条件下,也能和氯气发生取代反应。由于生成类似甲烷分子结构(正四面体),这说明甲烷分子中的氢原子完全被取代,则反应的化学方程式是CH4+4Cl2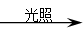 CCl4 + 4HCl。
CCl4 + 4HCl。
(6)铝是活泼的金属,只能通过电解法冶炼,则工业冶炼⑤的化学方程式是2Al2O3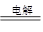 4Al +3O2↑。(7)海上中含有多种元素,其中K、Na、Cl、Br、Mg等元素可以从海水中通过一定的方法提取;海上中获取溴单质涉及到的反应有Cl2+2Br-=2Cl-+Br2、Br2+ SO2 +2H2O=H2SO4 +2HBr。
4Al +3O2↑。(7)海上中含有多种元素,其中K、Na、Cl、Br、Mg等元素可以从海水中通过一定的方法提取;海上中获取溴单质涉及到的反应有Cl2+2Br-=2Cl-+Br2、Br2+ SO2 +2H2O=H2SO4 +2HBr。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
