现有部分短周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是_____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4分)(1)6、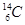 (各1分) (2) Cl、b (各1分)
(各1分) (2) Cl、b (各1分)
题目分析:M层上有2对成对电子,则根据构造原理可知,T元素应该是S元素。最外层电子数是次外层电子数的2倍,则X应该是碳元素。常温下单质为双原子分子,其氢化物水溶液呈碱性,因此Y是氮元素。元素最高正价是+7价,则Z是氯元素。非金属性强弱比较的一般规律是:①由单质和酸或者和水的反应程度判断:反应越剧烈,非金属性越强。②由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强。③由和氢气化合的难易程度判断:化合越容易,非金属性越强。④由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强。(除氟元素之外)。⑤由对应阴离子的还原性判断:还原性越强,对应非金属性越弱。⑥由置换反应判断:强置弱,据此可以判断元素的非金属性强弱。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查。试题基础性强,难易适中,侧重对学生基础知识的巩固和训练,有利于培养学生的逻辑推理和规范答题能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
