下表是元素周期表的一部分, 针对表中的①~⑩种元素,填写下列空白:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2) 在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______,碱性最强的化合
物的电子式是:_____________。
(3) ②的最高价氧化物的化学式为 写出其最高价氧化物的水化物与足量的铁粉反应的离子方程式_____________________________________________。
(4) 用电子式表示元素④与⑥的化合物的形成过程: ,
该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦、①与⑥形成的化合物的电子式 、 。
(6)③、⑥氢化物的沸点高低 ;原因
(7)④、⑥、⑦形成的简单离子的半径大小
(8)②和⑥形成的一种二元化合物具有色温效应,请相对分子质量在170~190之间,且⑥的质量分数约为70%。该化合物的化学式为_________________。
(9)④和③两种元素形成含有非极性键的化合物化学式为______,鉴别该化合物中含④元素常用方法 ;利用该化合物制取③单质的化学方程式 。
(19分,每空1分。)(1)Ar; ; 溴 ;Br2 + H2O =" HBr" + HBrO
; 溴 ;Br2 + H2O =" HBr" + HBrO
(2)HClO4; (3) N2O5;8H+ + 3Fe + 2NO3—= 3Fe3+ + 2NO↑ +4H2O
(3) N2O5;8H+ + 3Fe + 2NO3—= 3Fe3+ + 2NO↑ +4H2O
(4)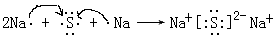 ; 离子
; 离子
(5)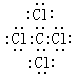 ;
; (6)H2O沸点高于H2S;H2O分子之间能形成氢键
(6)H2O沸点高于H2S;H2O分子之间能形成氢键
(7)S2- >Cl- >Na+ (8)S4N4(9)Na2O2 ;焰色反应 ; 2Na2O2 + 2CO2 =2Na2CO3 + O2
题目分析:(1)根据元素在周期表中的相对位置可知,在这些元素中,化学性质最不活泼的是Ar,其原子结构示意图为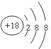 。元素⑩名称为溴,该单质与水反应化学方程式是Br2 + H2O = HBr + HBrO。
。元素⑩名称为溴,该单质与水反应化学方程式是Br2 + H2O = HBr + HBrO。
(2)非金属性越强,最高价氧化物的水化物的酸性越强,所以在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4。金属性越强,最高价氧化物的水化物的减小越强,则碱性最强的化合物是氢氧化钾,其电子式是 。
。
(3) ②是氮元素,最高价是+5价,所以其最高价氧化物的化学式为N2O5,该最高价氧化物的水化物是硝酸,与足量的铁粉反应的离子方程式8H+ + 3Fe + 2NO3—= 3Fe3+ + 2NO↑ +4H2O。 (4) 元素④与⑥形成的硫化钠,还有离子间属于离子化合物,其化合物用电子式表示形成过程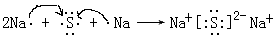 。
。
(5)①与⑦、①与⑥形成的化合物分别是四氯化碳和二硫化碳,都是含有共价键的共价化合物,其电子式分别是 、
、 。
。
(6)由于H2O分子之间能形成氢键,所以水的沸点高于H2S的沸点。
(7)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以④、⑥、⑦形成的简单离子的半径大小顺序是S2- >Cl- >Na+。
(8)②和⑥分别是N和S,由于二者形成的二元化合物的相对分子质量在170~190之间,且⑥的质量分数约为70%,所以该化合物中S原子的个数应该是介于 之间,所以S原子的个数是4个,则该化合物的相对分子质量是
之间,所以S原子的个数是4个,则该化合物的相对分子质量是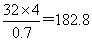 ,所以氮原子的个数是
,所以氮原子的个数是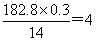 ,因此该化合物的化学式为S4N4。
,因此该化合物的化学式为S4N4。
(9)④和③两种元素形成含有非极性键的化合物是过氧化钠,其化学式为Na2O2;鉴别该化合物中含④元素常用方法焰色反应;利用该化合物制取③单质的化学方程式2Na2O2 + 2CO2 =2Na2CO3 + O2。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题注重基础,兼顾能力的培养和解题方法的指导与训练。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
