下表是元素周期表的一部分,请回答有关问题:
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
(2)表中能形成两性氢氧化物的元素是______(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式__________________________________________________。
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为______________________________________(用化学式表示)。
(4)③元素与⑩元素两者核电荷数之差是__________。
(5)请写出②的氢化物发生催化氧化的化学方程式________________。
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式 。
(每空2分,共14分):
(1) (2)铝 2Al+2KOH+2H2O===2KAlO2+3H2 ↑
(2)铝 2Al+2KOH+2H2O===2KAlO2+3H2 ↑
(3) KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4 (4) 26
(5)4NH3+5O2 4NO+6H2O
4NO+6H2O
(6) Al(OH)3+3H+=== Al3++3H2O
题目分析:由元素在周期表中的位置可知,①为C,②为N,③为F,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ar,⑨为K,⑩为Br。
(1)Ar的最外层电子数为8,为稳定结构,则化学性质不活泼,其原子结构示意图为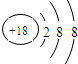 ,故答案为:
,故答案为: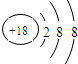 ;
;
(2)上述元素中只有Al的氢氧化物为两性,其离子反应为2Al+2KOH+2H2O===2KAlO2+3H2 ↑,故答案为:铝;2Al+2KOH+2H2O===2KAlO2+3H2 ↑;
(3)元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,其最高价氧化物的水化物的酸性越强,故碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4;
(4)③为F元素,核电核数为9, ⑩为Br ,核电核数为35,故两者核电荷数之差是26;
(5)②为N,其氢化物为NH3,故②的氢化物发生催化氧化的化学方程式为4NH3+5O2 4NO+6H2O;
4NO+6H2O;
(6)⑤为Al,其最高价氧化物的水化物为Al(OH)3;⑦为Cl,其最高价氧化物的水化物为HClO4,是强酸,故反应的离子方程式为Al(OH)3+3H+=== Al3++3H2O。
点评:本题考查位置、结构、性质的应用,元素的推断较简单,熟悉元素在周期表中的位置及单质、化合物的性质即可解答,难度不大。
