有A、B、C、D、E、F六种短周期的主族元素、原子序数依次增大,其中A、D元素的原子最外电子层均只有一个电子,且A和D可形成离子化合物;C、F同主族,B元素位于元素周期表中第二周期,且原子最外层电子数占核外电子总数的3/4,F元素原子最外电子层比同周期的E元素原子的最外电子层多4个电子,请回答:
(1)写出A、D两种元素组成的化合物的电子式 ;
(2)写出B、D、E三种元素组成的常见化合物的名称 ;
(3)工业生产E的方法是 ;
(4)D、E、F三元素最高价氧化物对应的水化物相互之间发生反应的离子方程式为:
、
、
。
(1)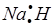 (2)偏铝酸钠 (3)电解法
(2)偏铝酸钠 (3)电解法
(4)H+ + OH- H2O、
Al(OH)3 + 3H+ Al3+ + 3H2O、
Al(OH)3 + OH- AlO2- + 2H2O
题目分析:A、B、C、D、E、F六种元素分别为H、O、F、Na、Al、Cl。(1)A、D两种元素组成的化合物为NaH;(2)B、D、E三种元素组成的常见化合物为NaAlO2;(3)Al的金属性较活泼,故工业上用电解法制备;(4)D、E、F三元素最高价氧化物对应的水化物分别为NaOH、Al(OH)3和HClO4;其中,NaOH为强碱,HClO4为强酸,水溶液中完全电离;Al(OH)3为两性化合物,书写离子方程式时要写化学式。
点评:元素周期规律是高考必考知识点,考生在备考中应牢牢把握各规律的递变,并注意积累掌握短周期元素的结构与性质。
