W、Q、A、B、X、Y、Z为原子序数依次增大的短周期元素,已知W与X在同一主族;Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F;A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水;X元素的最外层电子数比次外层电子数少4;Y元素的L层电子数等于K、M两个电子层上的电子数之和。
(1)W元素在周期表中的位置是 ;
淡黄色固体F中含有的化学键是 。
(2)A与Y两元素可形成化合物,用电子式表示此化合物的形成过程:
。
(3)写出A、B两元素的最高价氧化物的水化物发生反应的离子方程式:
。
(4)A、B、Y、Z四种元素的简单离子的离子半径由大到小的顺序为: 。(用离子符号表示)
(5)X、Y、Z三种元素的氢化物的稳定性由强到弱的顺序为: 。(用化学式表示)
(每空2分,共12分)
(1)第二周期、第IVA族(答不全不得分) ; 离子键、非极性共价键(答不全不得分)
(2)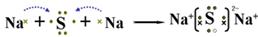
(3)Al(OH)3+ OH- = AlO2-+2H2O
(4)S2—>Cl—>Na+>Al3+
(5)HCl>H2S>SiH4
题目分析:根据Q的阴离子和A的阳离子具有相同的电子层结构,且两元素的单质反应,生成一种淡黄色的固体F,F为Na2O2,Q为O,A为Na。根据A、B、Z三种元素的原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,B为Al,Z为Cl。根据X元素的最外层电子数比次外层电子数少4,X为Si。根据W与X在同一主族,W为C。根据Y元素的L层电子数等于K、M两个电子层上的电子数之和,Y为S。
(1)W为C,故在周期表中的位置是第二周期、第IVA族。
淡黄色固体F为Na2O2,含有的化学键是离子键、非极性共价键。
(2)A与Y两元素形成化合物为Na2S,电子式表示此化合物的形成过程为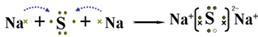 。
。
(3)A、B两元素的最高价氧化物的水化物分别为NaOH,Al(OH)3,反应的离子方程式为Al(OH)3+ OH- = AlO2-+2H2O。
(4)A、B、Y、Z四种元素的简单离子的离子分别为Na+、Al3+、S2—、Cl—,电子层数越多,半径越大;具有相同电子排布的离子,核电核数越大半径越小。故离子半径由大到小的顺序为S2—>Cl—>Na+>Al3+。
(5)X、Y、Z三种元素的氢化物分别为SiH4、H2S、HCl,元素的非金属性越强,对应其氢化物的稳定性越强,故氢化物的稳定性由强到弱的顺序为HCl>H2S>SiH4 。
点评:本题考查原子的符号,电子式,化学方程式的书写,难度不大。
