下表是元素周期表的一部分,针对表中①~⑩中的元素,回答以下问题:
| ① | |||||||||||||||||||||||||
| ② | ③ | ④ | ⑤ | ||||||||||||||||||||||
| ⑥ | ⑦ | ⑧ | ⑨ | ||||||||||||||||||||||
|
|
|
| ||||||||||||||||||||||
(2)在①~⑨元素中,原子半径最大的是 (填元素名称);①和③组成的化合物的电子式为 ;⑨的离子结构示意图为 。
(3)元素的最高价氧化物对应的水化物中酸性最强的是 (填化学式,下同),碱性最强的是 ,呈两性的是 。
(4)⑨和⑩中,非金属性较强的是 (填元素符号);可用一个化学反应说明该事实,写出该反应的离子方程式: 。
(每空1分,共9分)
(1)b
(2)钠, 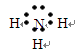 ,
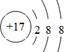
,
(3)HClO4,NaOH,Al(OH)3
(4)Cl, Cl2+2Br-=2Cl-+Br2
题目分析:(1)b的区域中是过度金属,故全部是金属元素的区域b。
(2)同周期,自左向右,原子半径逐渐减小;同主族,自上向下,原子半径逐渐增大。故原子半径最大的是⑥,即钠。①和③组成的化合物是NH3,电子式为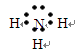 。⑨是Cl,其离子结构示意图为
。⑨是Cl,其离子结构示意图为 。
。
(3)同周期,自左向右,金属性逐渐减弱,非金属性逐渐增强;同主族,自上向下,金属性逐渐增强,非金属性逐渐减弱。元素的非金属性越强,其最高价氧化物对应的水化物中酸性最强,故为HClO4。元素的金属性越强,其最高价氧化物对应的水化物碱性最强的,故为NaOH。呈两性的是Al(OH)3。
(4)同周期,自左向右,金属性逐渐减弱,非金属性逐渐增强;同主族,自上向下,金属性逐渐增强,非金属性逐渐减弱。故非金属性⑨大于⑩,非金属性较强的是Cl。证明非金属性强弱的化学反应的离子方程式为Cl2+2Br-=2Cl-+Br2。
点评:本题考查学生元素周期表和元素周期律的综合知识,是一道综合题,难度较大。
