下表为元素周期表的一部分,请回答:
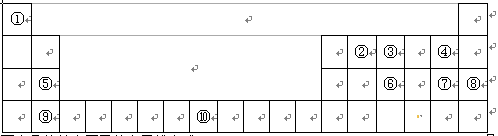
(1)写出⑩的基态原子的电子排布式: 。
(2)第一电离能:⑤ ⑨(填“ > ”、“ < ”或“ = ”)
(3)①~⑩元素中,电负性最大的是 (填元素符号,下同),第一电离能最大的是 。
(4)③、⑥分别形成的气态氢化物,稳定性较强的是 (填化学式,下同),沸点较高的是 ,原因: 。
(5)①与②形成的化合物,其VSEPR模型为 ;中心原子的杂化方式为
杂化;该分子为 分子(填“极性”或“非极性”)。
(1)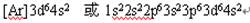
(2)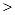
(3)F Ar
(4)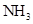
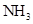
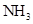 中存在氢键
中存在氢键
(5)正四面体 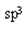 非极性
非极性
题目分析:(1)⑩为Fe元素,其基态原子的电子排布式为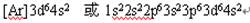 。
。
(2)同周期,自左向右电离能逐渐减弱,故第一电离能:⑤>⑨。
(3)同周期,自左向右电负性逐渐增强;同主族,自上而下电负性逐渐减弱。故①~⑩元素中,电负性最大的是F元素;第一电离能最大的是Ar元素。
(4)③是非金属性大于⑥的非金属性,故③形成的气态氢化物稳定性较强,为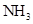 。
。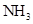 中含有氢键,沸点较高。
中含有氢键,沸点较高。
(5)①与②形成的化合物为CH4,其VSEPR模型为正四面体,中心原子的杂化方式为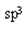 杂化;该分子为非极性分子。
杂化;该分子为非极性分子。
点评:本题考查物质的结构,涉及到分子结构、杂化轨道等抽象内容,具有一定难度。但此类题目近年来在高考中已被逐渐淡化。解答此类题型,要求考生具有丰富的想象力。
