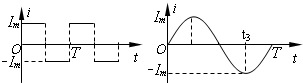已知X、Y、Z、W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物在常温下均呈气态,在周期表中Z与W左右相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同。请回答下列问题:
(1)Z基态原子的核外电子排布式是 ;
(2)X、Y可组成一化合物,其原子个数之比为5:1。其化学式中含有的化学键有 。
(3)YX3分子的空间构型是 ,中心原子的杂化方式是 ;Y的氢化物的沸点比W的氢化物的沸点 (填“高”或“低”)。
(4)Z2W2分子中,W与Z均满足8e-稳定结构,则Z 2W2的电子式为 。
(共12分)(1)1s22s22p63s23p4(2分) (2) 极性键、离子键、配位键(2分) (3)三角锥形;sp3 ;高(每空2分)
(4)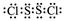 ((2分)
((2分)
题目分析:X与Y、Z、W所形成的常见化合物在常温下均呈气态,,多为氢化物,则X为H元素,Y的最高价氧化物对应的水化物与其氢化物反应生成盐,则Y应为N元素,形成的化合物NH4NO3,Y的核电荷数为7,与W的最外层电子数相同,则W可能为F,也可能为Cl元素,如W为F元素,则Z为O元素,Z对应的氢化物为H2O,在常温下为液体,不成立,所以W为Cl元素,Z为S元素。
(1)Z为S元素,其基态原子的核外电子排布式是1s22s22p63s23p4。
(2)X、Y可组成一化合物,其原子个数之比为5:1,分子式为NH5,即NH4H,氢化铵,含有的化学键有极性键、离子键、配位键。
(3)YX3为NH3,空间构型是三角锥形,中心原子的杂化方式是sp3,Y的氢化物(即NH3)的沸点比W的氢化物(即HF)的沸点高。
(4)Z2W2为S2F2,电子式为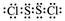 。
。
点评:本题考查元素的推断,题目难度中等,注意首先判断生成物,根据质量守恒定律书写化学方程式。

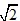
 :1
:1