元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。请回答:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
⑤和⑥形成化合物的电子式
(2)在这些元素的最高价氧化物对应的水化物中,碱性最强的是(填化学式)。
酸性最强的是 呈两性的是 ,写出三者之间相互反应的化学方程式 ;
(3)①、②、③三种元素按原子半径由大到小的顺序依次为 (填元素符号)。
(4) 用电子式表示⑧元素与③元素形成化合物的过程 。
(5) 在①和②中化学性质最活泼的是
(6)在⑦和⑧中化学性质最活泼的是 ,用化学实验证明的方法和离子方程式:
方法
离子方程式
(1)C Ar 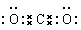
(2) KOH HClO4 Al(OH)3 KOH +HClO4=KClO4 +H2O KOH + Al(OH)3=KAlO2 +2H2O
(3) K>Na>Mg (4)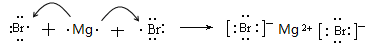 (5)K
(5)K
(6) Cl 取适量溴化钠溶液滴入氯水,溶液变为橙黄色,则非金属性Cl>Br Cl2 + 2Br-= 2Cl- + Br2
题目分析:(1)根据元素在周期表中的相对位置可知①~⑨九种元素分别是Na、K、Mg、Al、C、O、Cl、Br、Ar。Ar是稀有气体元素,化学性质最不活泼。⑤和⑥形成化合物是CO2,含有共价键的共价化合物,其电子式是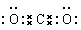 。
。
(2)金属性或非金属性越强,最高价氧化物的水化物的碱性或酸性越强,则KOH的碱性最强,HClO4的酸性最强, Al(OH)3是两性氢氧化物。
(3)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则三种元素的原子半径大小顺序是K>Na>Mg。
(4)示⑧元素与③元素形成化合物是溴化镁,含有离子键,其形成过程可表示为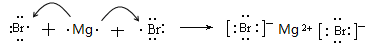 。
。
(5)同主族自上而下,金属性逐渐增强,所以K的金属性强于Na的金属性。
(6)同主族自上而下,非金属性逐渐减弱,所以Cl的非金属性强于Br的非金属性。可根据非金属性强的单质转换弱,即取适量溴化钠溶液滴入氯水,溶液变为橙黄色,则非金属性Cl>Br,所以的离子方程式是Cl2 + 2Br-=2Cl- + Br2。
点评:该题是基础性试题的考查,侧重对学生基础知识巩固和训练的同时,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和规范答题能力。
