二甲醚(CH3OCH3)被称为21世纪的新型能源,它清洁、高效、具有优良的环保性能.
Ⅰ.工业制备二甲醚的生产流程如下:
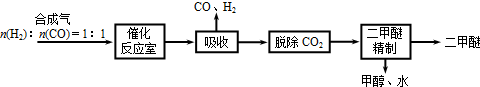
催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
(1)甲烷氧化可制合成气:CH4(g)+
O2(g)⇌CO(g)+2H2(g)△H=-35.6kJ/mol,该反应是______反应(填“自发”或“非自发”).1 2
(2)催化反应室中总反应3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)的△H=______.830℃时反应③的K=1.0,则在催化反应室中反应③的K______1.0(填“>”、“<”或“=”)
(3)上述流程中,可循环使用的物质有______.
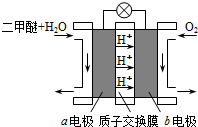
Ⅱ.如图为绿色电源“直接二甲醚燃料电池”的工作原理示意图.
(1)b电极是______极.
(2)a电极的反应式为______.
I.(1)甲烷氧化可制合成气:CH4(g)+
O2(g)⇌CO(g)+2H2(g)△H=-35.6kJ/mol,△S>0,△H<0,;△H-T△S<0,反应能自发进行,故答案为:自发;1 2
(2)催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应.
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
依据盖斯定律①×2+②+③得到:3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g)△H=-246.1kJ/mol;
830℃时反应③的K=1.0,则在催化反应室中,压力2.0~10.0Mpa,温度230~280℃,温度降低.平衡正向进行,反应③的K增大;
故答案为:-246.1kJ/mol;>;
(3)依据催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应.
①CO(g)+2H2(g)⇌CH3OH(g)△H=-90.7kJ/mol
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H=-23.5kJ/mol
③CO(g)+H2O(g)⇌CO2(g)+H2(g)△H=-41.2kJ/mol
CO、甲醇和水,是中间产物,H2也可以部分循环,故答案为:CO、H2、甲醇和水;
II.反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极反应还原反应,氧气在正极放电.由图可知,a极为负极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O=2CO2+12H+,b为正极,氧气得到电子发生还原反应,故答案为:正;CH3OCH3+3H2O-12e-=2CO2+12H+.

