下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
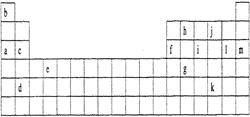
(1)下列 (填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:①原子核对核外电子的吸引力,②形成稳定结构的倾向。下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
②表中的X可能为以上13种元素中的 (用字母序号填写)元素,这种元素和j形成的化合物中若存在共价键,则该化合物的电子式是 ,这种物质属于 (填“离子”或“共价”)化合物。
③Y在周期表中是 族的元素。
④在以上13种元素中, (用字母序号填写)元素原子失去核外第一个电子需要的能量最多。
(1)①④(2分,对一个得1分,错一个扣1分,扣完为止)
(2)①Li原子失去一个电子后,Li+已形成稳定结构,此时再失去一个电子很困难(2分)
②a(1分); (2分);离子(1分)
(2分);离子(1分)
③ⅢA(或第三主族)(1分)
④m(1分)
题目分析:a-m元素分别为Na、H、Mg、Ba、Ti、Al、Ge、C、P、O、Te、Cl、Ar。(1)电的良导体主要为金属、石墨、人体、大地以及酸、碱、盐的水溶液等。(2)元素X失去第一个电子所需能量远远小于失去第二个电子所需的能量,故X元素位于第一主族,为Na;与j形成的化合物有Na2O和Na2O2,其中Na2O2含有共价键;m为稀有气体元素,已达稳定结构,故很难失去电子。
点评:元素周期规律是高考必考知识点,考生在备考中应牢牢把握各规律的递变,并注意积累掌握短周期元素的结构与性质。
