(16分)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
(1)写出CO2与H2反应生成CH4和H2O的热化学方程式 。
已知: ① CO(g)+H2O(g) H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
② C(s)+2H2(g) CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
③ 2CO(g) C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)另一生成CH4的途径是CO(g)+3H2(g) CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。
CH4(g)+H2O(g)。其他条件相同时,H2的平衡转化率在不同压强下随温度的变化如图所示。

①该反应的△H 0(填“<”、“=”或“>”)。
②实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑生产实际,说明选择该反应条件的理由________________________。
③某温度下,将0.1 mol CO和0.3 mol H2充入10L的密闭容器内发生反应CO(g)+3H2(g)  CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K。(写出计算过程,计算结果保留两位有效数字)
(1)CO2(g)+4H2(g)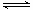 CH4(g)+2H2O(g) ΔH=-162kJ·mol-1 (3分,热化学方程式2分,数据1分)
CH4(g)+2H2O(g) ΔH=-162kJ·mol-1 (3分,热化学方程式2分,数据1分)
(2)①< (3分)
②相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高。 (3分)
③(7分)
CO(g)+3H2(g) 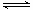 CH4(g)+H2O(g)
CH4(g)+H2O(g)
起始时各物质浓度/ mol·L-1: 0.01 0 .03 0 0
平衡时各物质浓度/ mol·L-1 0.002 0.006 0.008 0.008
(以上3分)
K=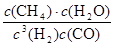 =
=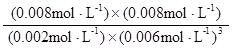 =0.148×106
=0.148×106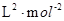
(1分) (1分) (2分,数据和单位各1分)
题目分析:
⑴先写出该反应的方程式,并标明各物质的状态:CO2(g)+4H2(g)=CH4(g)+2H2O(g);将“②+③-①×2”能得该反应方程式,再根据盖斯定律可计算该反应的反应热△H=(-73kJ•mol-1)+(-171kJ•mol-1)-(-41kJ•mol-1)×2=-162kJ•mol-1,综上便可写出完整的热化学方程式。
⑵①由图可知,压强一定时,升高温度,平衡时氢气的转化率降低,平衡向逆反应方向移动,正反应为放热反应,则△H<0;
②相对于N点而言,采用M点,温度在500-600K之间,温度较高,反应速率较快,氢气的平衡转化率也较高,压强为常压对设备要求不高;
③平衡时H2的转化率为80%,参加反应氢气的物质的量=0.3mol×80%=0.24mol,则氢气的浓度变化量=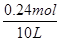 =0.024mol/L,然后结合三段分析如下:
=0.024mol/L,然后结合三段分析如下:
CO(g)+3H2(g)⇌CH4(g)+H2O(g)
开始(mol/L):0.01 0.03 0 0
变化(mol/L):0.008 0.024 0.008 0.008
平衡(mol/L):0.002 0.006 0.008 0.008
故平衡常数K=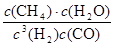 =
=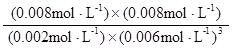 =0.148×106
=0.148×106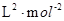 。
。
