下图是元素周期表的框架,请在表中①~⑩元素中回答问题
| ① | |||||||||||||||||
| ② | ③ | ④ | |||||||||||||||
| ⑤ | ⑥ | ⑦ | ⑧ | ||||||||||||||
| ⑨ | ⑩ | ||||||||||||||||
(1)在表中④、⑤、⑥三种元素的简单离子半径由大到小的顺序为__________________________。
(2)其中⑤与⑦两元素的最高价氧化物的水化物反应的离子方程式为_______________________。
(3)⑧与⑩两种元素非金属较强的是________,请用一个离子方程式证明该结论_________。
(4)①与③的两种单质可以在金属铂做电极时构成一种对环境友好的燃料电池,电解质为⑨的最高价氧化物的水化物,请书写出正极反应式_____________________,电池工作时阴离子定向移动到________极(填正或负)。
(5)元素①与⑧的两种单质在一定条件下可反应生成一种化合物甲,已知下表中的数据是破坏1 mol物质中的化学键所吸收的能量(kJ),则生成1mol甲时释放的能量为____________kJ。
| 化学键 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1) F->Na+>Mg2+ ;(2) Al(OH)3+OH-=AlO2-+2H2O ;
(3) Cl>Br Cl2+2Br-=2Cl-+Br2 ;
(4) O2+4e- +2H2O=4OH- , 负 极;(5) 92.5 kJ。
题目分析:由上图可以推断出①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩分别为H、N、O、F、Na、Mg、Al、Cl、K、Br。(1)中,④、⑤、⑥分别为F、Na、Mg,所以离子半径由大到小的顺序为F->Na+>Mg2+;(2)⑤与⑦两元素的最高价氧化物的水化物分别为氢氧化钠和氢氧化铝,所以两者的反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O;(3)⑧与⑩两种元素非金属较强的是Cl>Br,可以通过往溴化钠溶液中通入氯气来检验,所以其离子方程式为Cl2+2Br-=2Cl-+Br2;(4) )①与③的两种单质在金属铂做电极时构成一种对环境友好的燃料电池为氢氧燃料电池,是以氢氧化钾为电解质溶液,所以其正极反应式为O2+4e- +2H2O=4OH-,由于负极产生了阳离子,所以电池工作时阴离子定向移动到负极;(5)元素①与⑧的两种单质在一定条件下生成的化合物为HCl,其化学反应方程式为:H2+Cl2=2HCl故生成1mol甲时释放的能量为(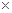 432-436-243)/2="92.5" Kj.
432-436-243)/2="92.5" Kj.
点评:该题考查了元素周期表中部分元素及其化合物的性质,该题信息量比较大,有一定的综合性,是一道不错的推断题。
