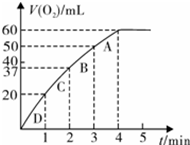
加入0.10mol MnO2粉末于50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示.
①写出H2O2在二氧化锰作用下发生反应的化学方程式______.
②实验时放出气体的总体积是______mL.
③放出1/3气体所需时间为______ min.
④反应放出3/4气体所需时间约为______ min.
⑤A、B、C、D各点反应速率快慢的顺序为______>______>______>______.
⑥解释反应速率变化的原因______.
⑦计算H2O2的初始物质的量浓度______.(请保留两位有效数字)
①由题意知,反应物为H2O2,生成物为水和氧气,反应条件为二氧化锰作催化剂,
则反应的方程式为2H2O2
2H2O+O2↑, MnO2 .
故答案为:2H2O2
2H2O+O2↑; MnO2 .
②由图象可知,反应至4min时,H2O2完全反应,生成气体的总体积是60ml,故答案为:60;
③放出
气体时,气体的体积为1 3
×60ml=20ml,对应的时间为1min,故答案为:1;1 3
④反应放出
气体时,气体的体积为3 4
×60ml=45ml,对应的时间约为2.5min,故答案为:2.5;3 4
⑤由曲线的变化特点可以看出,曲线的斜率逐渐变小,说明反应逐渐减慢,则反应速率D>C>B>A,
故答案为:D;C;B;A;
⑥随着反应的进行,H2O2逐渐被消耗,反应物H2O2的浓度逐渐降低,则反应速率逐渐减小,故答案为:随着反应的进行,浓度减小,反应速率减慢;
⑦根据方程式计算:
2H2O2
2H2O+O2↑ MnO2 .
2mol 22.4L
n 0.06L
n=
=0.0054mol2mol×0.06L 22.4L
c=
=n V
=0.11mol/L,故答案为:0.11mol/L.0.0054mol 0.05L
