下列是初中化学部分重要的实验装置。请按要求填空:
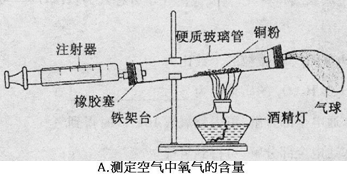

(1)A中为了测定空气中氧气的含量,采用化学方法除去空气中的氧气,发生反应的化学方程式: ;若装置气密性良好,实验所测得氧气的含量小于21%,其原因可能① ,② 。
(2)B实验a中看到的现象是 ,用化学方程式表示该现象的原因 ;b装置中的现象能说明二氧化碳具有 性质,这一性质在实际生活中的应用为 。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是 。
小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 | 镁 | 含碳0.05%的铁 | 含碳0.2%的铁 | 含碳0.6%的铁 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填) |
②造成铁丝在氧气中燃烧时火星四射的主要原因是 。
(1)2Cu + O2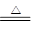 2CuO
2CuO
①铜粉的量太少,氧气未消耗完
②未冷却到室温就读数(或推拉注射器活塞次数太少,没有使密闭容器中氧气充分与铜反应,或加热温度不够高,铜粉与氧气反应不充分等等)
(2)紫色石蕊试液变为红色 H2O+CO2===H2CO3 本身不燃烧、不支持燃烧、密度比空气大 灭火
(3)集气瓶中没有放少量水或铺一层细沙
①剧烈燃烧,火星四射 ②铁丝中含有的碳引起的
题目分析:(1)硬质玻璃管内有铜,铜与氧气可生成氧化铜以除去氧气;加入的铜粉不足或未冷却到室温就读数或或推拉注射器活塞次数太少,没有使密闭容器中氧气充分与铜反应,或加热温度不够高,铜粉与氧气反应不充分等等均会导致测定的氧气的含量偏少;
(2)二氧化碳能水反应生成碳酸,碳酸呈酸性,能使紫色石蕊试液变为红色;b中蜡烛熄灭可以说明二氧化碳既不能燃烧也不能支持燃烧;
(3)铁燃烧时的生成物温度很高,若集气瓶中没有放少量水或铺一层细沙集气瓶会炸裂;根据表格现象可知,含碳量越高,燃烧越剧烈,那么表中未填的实验现象是剧烈燃烧,火星四射。
