X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子。
③Z元素的电离能(用符号I表示)数据见表(kJ·mol-1)
| I1 | I2 | I3 | I4 | … |
| 496 | 4 562 | 6 912 | 9 540 | … |
⑴Z2Y中含有的化学键类型为 。
⑵Z2Y2的电子式为 。
⑶X2Y分子的空间构型为 ,其中心原子的杂化方式为 ,XWY属于________(填“极性”或“非极性”)分子。
⑴ 离子键 ⑵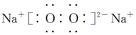 ⑶V形; sp3;极性
⑶V形; sp3;极性
题目分析:X元素原子的价电子排布式为ns1,且原子半径是同族元素最小的,这说明X是氢元素。Y元素是地壳中含量最多的元素,则Y是氧元素;W元素的电负性略小于Y元素,在W原子的电子排布式中,p轨道上只有1个未成对电子,且W的原子序数大于氧元素的,这说明W应该是氯元素。根据Z元素的电离能可知,Z的第二电离能远远大于第一电离能,这说明Z是第IA族元素,所以根据Z的原子序数可知,Z应该是钠元素。
(1)氧化钠中含有离子键。
(2)过氧化钠中含有离子键和非极性键,则电子式是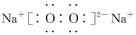 。
。
(3)水分子中氧原子含有的孤对电子对数=(6-2×1)÷2=2,所以水是V形结构,氧原子是sp3杂化。HClO分子中电荷不能重合,所以是极性分子。
点评:该题是高考中的常见考点,属于中等难度的试题的考查,试题贴近高考,基础性强。侧重对学生灵活运用基础知识解决实际问题的能力,有利于培养学生分析、归纳和总结问题的能力。
