A、B、C、D、E、F六种短周期元素,原子序数依次增大。A是地壳中含量最高的元素,C是地壳中含量最高的金属元素,A、E同主族。D元素原子最外层电子数是次外层电子数的一半。B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数。
回答下列问题:
(1)元素A在元素周期表中的位置是 。
(2) 写出B、E两元素形成化合物的电子式: ,所含化学键类型 ;
(3)A、D、E、F的气态氢化物的稳定性顺序 (用化学式表示)
(4)写出C、E对应的最高价氧化物的水化物相互反应的化学方程式为:
(5)C、D的氧化物与分别与B的氢氧化物反应的离子方程式:
、
(1)第二周期,ⅥA族 ;
(2) 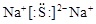 离子键
离子键
(3) H2O> HCl>H2S>SiH4
(4)2Al(OH)3 +3 H2SO4 ="=" Al2(SO4)3 +6H2O
(5)Al2O3 +2OH— ==2AlO2— +H2O SiO2 + 2OH— ==SiO32— +H2O
题目分析:A是地壳中含量最高的元素,故A为O,C是地壳中含量最高的金属元素,故C为Al,A、E同主族,故E为S;D元素原子最外层电子数是次外层电子数的一半,故D为Si;B、C两元素原子的最外层电子数之和等于D元素原子的最外层电子数,故B为Na,C、D两元素原子最外层电子数之和等于F元素原子的最外层电子数,故F为Cl,所以A、B、C、D、E、F分别为O、Na、Al、Si、S、Cl。(1)元素A在元素周期表中的位置是:第二周期,ⅥA族;(2) B、E两元素形成化合物为硫化钠,其电子式为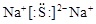 ,所含化学键类型为离子键;(3)根据元素的电负性越大,气态氢化物越稳定,所以A、D、E、F的气态氢化物的稳定性顺序为:H2O> HCl>H2S>SiH4;(4)C、E对应的最高价氧化物的水化物分别为氢氧化铝和硫酸,两者发生的化学反应方程式为:2Al(OH)3 +3 H2SO4 ="=" Al2(SO4)3 +6H2O;
,所含化学键类型为离子键;(3)根据元素的电负性越大,气态氢化物越稳定,所以A、D、E、F的气态氢化物的稳定性顺序为:H2O> HCl>H2S>SiH4;(4)C、E对应的最高价氧化物的水化物分别为氢氧化铝和硫酸,两者发生的化学反应方程式为:2Al(OH)3 +3 H2SO4 ="=" Al2(SO4)3 +6H2O;
(5)C、D的氧化物分别为氧化铝和二氧化硅,其与氢氧化钠的反应的离子方程式分别为:
Al2O3 +2OH— ==2AlO2— +H2O SiO2 + 2OH— ==SiO32— +H2O。
点评:本题考查了元素周期表、元素周期律、元素及其化合物,解答本题的关键是先推断出A、B、C、D、E、F分别为O、Na、Al、Si、S、Cl,然后再解答,本题难度中等。
