(1)利用盖斯定律可以从已经精确测定的反应热效应来计算难于测量或不能测量的反应的热效应。已知:N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1。
请写出气态肼与NO2气体完全反应生成氮气和水蒸气的热化学方程式: 。
(2)已知:N≡N的键能是946kJ·mol-1,H—H的键能为436kJ·mol-1,N—H的键
能为393kJ·mol-1,计算合成氨反应生成1molNH3的△H= kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,
①该Ba(OH)2溶液的物质的量浓度为________
②加水稀释100倍,所得溶液中由水电离出c(OH-)=____________
③与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合后,所得溶液pH=11,该盐酸溶液的pH=________。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 (填“酸性”,“中性”或“碱性”,下同),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=” 或“<” )。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 ,溶液中c(Na+)
c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 ,醋酸体积 氢氧化钠溶液体积。
(1)2N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g) ΔH=" -1135.7" kJ·mol-1 (2分)
(2)-52kJ·mol-1(2分)
(3)① 0.05mo1·L-1 (1分) ②1×10-11mo1/L(2分) ③ 2(2分)
(4)(1)碱性,>;(2分) (2)酸性,<;(2分) (3)中性,>; (2分)
题目分析:(1)根据盖斯定律:①N2H4(g)+ O2(g)="=" N2(g)+ 2H2O(g) ΔH=" -534" kJ·mol-1
②N2(g)+ 2O2(g)="=" 2NO2(g) ΔH=" +67.7" kJ·mol-1,
①×2-②:2N2H4(g)+ 2NO2(g)= 3N2(g)+ 4H2O(g) ΔH=" -1135.7" kJ·mol-1。
(2)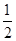 N2(g)+
N2(g)+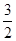 H2(g)
H2(g) NH3(g)的
NH3(g)的
△H=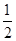 ×946kJ·mol-1+
×946kJ·mol-1+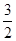 ×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
×436kJ·mol-1-3×393kJ·mol-1=-52kJ·mol-1。
(3)现有25℃、pH=13的Ba(OH)2溶液,c(H+)=10-13mol/L,c(OH-)=10-1mol/L,
①故Ba(OH)2溶液的物质的量浓度为0.05mol/L;
②加水稀释100倍,c(OH-)=10-3mol/L,这是Kw=c(OH-)·c(H+)水=10-14,溶液中由水电离出c(OH-)=c(H+)水=10-11mol/L。
③溶液pH=11,即c(OH-)=10-3mol/L,它与某浓度盐酸溶液按体积比(碱与酸之比)1 : 9混合:
1×10-1 mol/L -9×c(H+)HCl=10×10-3mol/L,c(H+)HCl=0.01mol/L,故该盐酸溶液的pH=2。
(4)回答醋酸与氢氧化钠反应的有关问题
①将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后生成CH3COONa,其水解溶液呈碱性,溶液中c(Na+)>c(CH3COO-)。
②pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合,CH3COOH已电离的与NaOH发生反应,醋酸仍继续电离使溶液呈酸性,溶液中c(Na+)<c(CH3COO-) .
③物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,根据电荷守恒可以推出c(OH-)=c(H+),则混合后溶液呈中性,由①可知,醋酸体积大于氢氧化钠溶液体积。3COOH溶液后的酸碱性判断等。
