化学变化中既有物质变化,也有能量变化,研究化学反应有利于指导工业生产.下列是常见的化学反应:①电解熔融氯化钠②氮气与氢气合成氨气③锌与稀硫酸反应④煅烧石灰石.
(1)从不同角度可以对上述反应进行分类:从反应前后能量变化角度看上述反应属于放热反应的是______(填序号,下同);从有无电子转移角度看上述反应属于非氧化还原反应的是______;从反应前后物质种类的变化角度看,①和④均属于______反应;①和②在变化过程中断裂的化学键类型分别为______、______.
(2)反应③在实验室中用于制备氢气,要提高生成氢气的速率下列措施合理的是______.
a.加入硝酸,增大氢离子的浓度b.用浓硫酸代替稀硫酸
c.加入少量铜粉d.将稀硫酸的体积加倍.
反应③可以设计成原电池反应,其中负极上反应的物质是______,电子流向______极.
(3)反应②是可逆反应,常应用于工业生产,升高温度正反应速率______(填“增大”、“减小”或“不变”,下同),逆反应速率______;请列举一项该反应达到平衡的标志______.
(1)①电解熔融氯化钠,是分解反应,为吸热反应,故①错误;
②氮气与氢气合成氨气,是化合反应,为放热反应,故②正确;
③锌与稀硫酸反应,是金属与酸反应,为放热反应,故③正确;
④煅烧石灰石,是分解反应,为吸热反应,故④错误;
所以从反应前后能量变化角度看上述反应属于放热反应的是②③;
①电解熔融氯化钠中元素钠和氯的化合价发生了变化,是氧化还原反应;
②氮气与氢气合成氨气中氮元素和氢元素的化合价发生了变化,是氧化还原反应;
③锌与稀硫酸反应中锌元素和氢元素的化合价发生了变化,是氧化还原反应;
④煅烧石灰石中元素的化合价未发生变化,是非氧化还原反应;
所以从有无电子转移角度看上述反应属于非氧化还原反应的为④;
反应①和④均是一种物质生成两种其他物质的反应,属于分解,
电解熔融氯化钠中断裂的是钠离子和氯离子之间的离子键;氮气与氢气合成氨气中断裂的是氮原子和氮原子、氢原子和氢原子间的共价键,
故答案为:②③;④;分解;离子键;共价键;
(2)a.加入硝酸,增大氢离子的浓度,但硝酸与金属反应产生一氧化氮,得不到氢气,故a错误;
b.用浓硫酸代替稀硫酸,浓硫酸与锌反应产生二氧化硫,得不到氢气,故b错误;
c.加入少量铜粉,铜、锌、稀硫酸形成原电池,加快了反应,故c正确;
d.将稀硫酸的体积加倍,氢离子的浓度减小,反应速率减慢,故d错误;
铜、锌、稀硫酸形成原电池,锌为活泼金属,发生氧化反应,为负极;电子从负极经导线流向正极,
故答案为:c;锌;正;
(3)根据温度升高,正反应速率、逆反应速率都增大,可逆反应达到平衡时,各物质的浓度不变,反应速率相等,
故答案为:增大;增大;正反应速率等于逆反应速率.

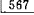 缺失,可摘局部义齿修复1个月。主诉:义齿压痛。检查发现:
缺失,可摘局部义齿修复1个月。主诉:义齿压痛。检查发现: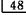 基牙为双臂卡环固位体,承托区黏膜弥散性红肿
基牙为双臂卡环固位体,承托区黏膜弥散性红肿