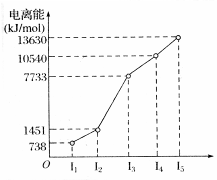
X、Y、Z三种元素,原子序数依次减小。X是第四周期主族元素,其部分电离能如图所示;X、Y元素具有相同的最高正化合价;Z原子价电子排布式nsnnpn。回答下列问题:
(1)X原子的电子排布式为 。
(2)电负性:X Y(填“>”、“=”或“<”)。
(3)元素Z的一种氢化物(化学式为Z2H4)是重要的化工原料。 有关Z2H4分子的说法正确的是 (填字母)。
A.分子中含有氢键
B.属于非极性分子
C.含有4个σ键和1个π键
D.Z原子的杂化方式为sp2
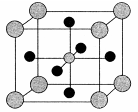
(4)X的氧化物与钛(Ti)的氧化物相互作用,能形成钛酸盐,其晶体结构如图所示(X、Ti和O三种元素对应的离子分别位于立方体的体心、顶点和面心)。该晶体中,钛离子和周围 (填数字)个氧离子相紧邻。
(5)NH4Cl晶体中含有多种化学键,其中一定不含有的化学键是 (填字母)。
A.离子键 B.非极性键 C.配位键 D.金属键
(6分)
(1)1s22s22p63s23p63d64s2 (1分) (2)<(1分)
(3)B、D(2分) (4)12(2分) (5)B、D(2分)
题目分析:X是第四周期主族元素,电离能图所示可知最外层2个电子,为Ca;X、Y元素具有相同的最高正化合价,推得Y是Mg;Z原子价电子排布式nsnnpn,n必为2,Z是C。
(1)Ca原子的电子排布式为1s22s22p63s23p63d64s2。
(2)同主族电负性从上往下逐渐减小。
(3)乙烯C2H4属于非极性分子,C原子的价电子对为(4+2)/2=3,sp2杂化 。
(4)钛离子和周围氧离子个数1/2×3×8="12" 。
(5)NH4Cl晶体中含有离子键、配位键、极性共价键。
