问题
填空题
A、B、C、D、E、F周表前四周期中的常见元素,其相关信息如下表:
| 元素 | 相关信息 |
| A | A是周期表中原子半径最小的元素 |
| B | B元素的原子价电子排布为ns11np14 |
| C | M的基态原子L层电子数是K层电子数的3倍 |
| D | D是第三周期中第一电离能最小的元素 |
| E | E是地壳中含量最多的金属元素 |
| F | 有多种化合价,其某种高价阳离子的价电子具有较稳定的半充满结构 |
(1)F位于元素周期表中位置 ,其基态原子核外价电子排布式为 ;
(2)B的电负性比M的 (填“大”或“小”);B2A3分子中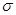 键与
键与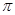 键与个数之比为 ;
键与个数之比为 ;
(3)写出E的单质与D的最高价氧化物的水化物溶液反应的化学方程式: ;
(4)已知每5.4gE可与最低价F的氧化物反应,放出346.2kJ的热量。则请写出该反应的热化学方程式: 。
答案
(12分,每空2分)
(1)第四周期Ⅷ族3d64s2
(2)小 5:1
(3)2A1+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
(4)2Al(s)+3FeO(s)=2A12O3(s)+3Fe(s) △H=-3462kJ/mol
题目分析:由题中所给条件可知A为氢元素,B为碳元素,C为氧元素,D为钠元素,E为铝元素,F为铁元素。(2)元素的非金属性越强,则电负性越大;C2H4分子中有1个双键和4个单键,故有1个π键,5个σ键。(4)写出化学方程式即可计算出△H,书写热化学方程式时应注意写明各物质的状态。
