甲同学用一氧化碳还原铁的氧化物,取不同质量的铁的氧化物进行实验,所得到的数据如下表所示:
| 实验序号 | 铁的氧化物质量/g | 生成铁的质量/g |
| 1 | 4.00 | 2.81 |
| 2 | 8.00 | 7.62 |
| 3 | 10.00 | 7.01 |
| 4 | 12.00 | 8.42 |
| 5 | 14.00 | 9.81 |
| 6 | 16.00 | 11.22 |
| 7 | 18.00 | 12.63 |
| 8 | 20.00 | 14.03 |
(2)从图上可以看出甲进行第二次实验时,所得数据不十分可靠,故舍去.请分析造成此种结果的原因:______.
(3)请利用图回答,第二次实验时生成的铁的质量为______g(保留小数点后一位).
(4)如果另一同学乙取了25g铁的氧化物样品,而来不及做实验,但根据上述图示,可以求出所生成的铁的质为______g(保留小数点后一位).将你所用的方法在上图中画出.
(5)同学丙看了甲、乙两同学所做的方法后,认为只要认真进行两次实验,就可回答上述问题.请用甲同学的两组实验数据用数学方法写出丙同学的分析过程.
(6)丁同学看了上述分析过程后,认为只要一组准确的实验数据就能解决问题.他是怎样分析的?

(1)根据题干表格中提供的实验数据找点描出即可,故答案为: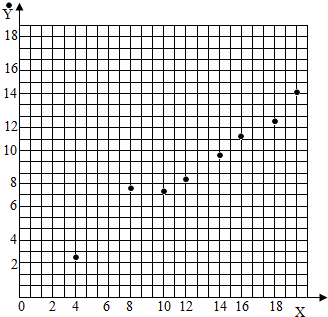
(2)甲进行第二次实验时,所得数据不十分可靠,可能的原因是反应的时间太短或温度太低造成反应不完全,故填:反应时间太短或温度太低
(3)据表格可知,每4g铁的氧化物生成铁的质量为2.81g,则8g铁的氧化物生成铁的质量为2.81g×2=5.62g,保留小数点后一位,则为5.6g,故填:5.6;
(4)25g铁的氧化物样品生成铁的质量可以在图上将点连线,作直线的延长线,数据大约为17.5,故填:17.5,在图上作直线延长线
(5)根据题干提供的数据,选择铁的氧化物为4.00g和20.0g,可得直线方程为:2.81=4k+b,14.03=20k+b解得k=0.70,b=0,所以y=0.7x,当x=8时,y=5.6;当x=25时,y=17.5
(6)因为没有反应物就没有生成物,所以过原点的直线方程只能是y=kx.
