下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | a | b | ||||||
| 3 | c | d | e | f | g | h | ||
| 4 | J | k |
(1)写出a的原子的最外层电子排布式 ,a的原子最外层有 个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是 ;最强碱与两性氢氧化物反应的化学方程式为: 。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序: (用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是 (用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是( )
A.单质熔点: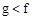
B.最高价氧化物对应水化物的酸性: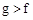
C.最高价氧化物对应水化物的溶解性: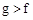
D.f不能与氢气反应,g能与氢气反应
(1)2s22p3 (1分) 3 (1分)
(1)HClO4 (1分) KOH + Al(OH)3→KAlO2 +2H2O (1分)
(1)S2― >Cl― >K+ (1分) F― +H2O  HF +OH― (1分)
HF +OH― (1分)
(1)BD (2分)
题目分析:
(1)根据题意可知a:N 原子的最外层电子排布式2s22p3 ,p轨道有 3个未成对电子。
(1)a:N、b:F、c:Na、d:Mg、e:Al、f:Si、g:S 、 h:Cl、 J:K 、k:Br
同周期非金属性增强,同主族非金属减弱,非金属性越强,高价氧酸酸性强。非金属性最强为F。F没含氧酸,最强的含氧酸为HClO4;同周期金属性减弱,同主族金属性增强,金属性越强,高价氧化物对应的水化物碱性强。最强碱:KOH两性氢氧化物:Al(OH)3 。反应为:KOH + Al(OH)3 =KAlO2 +2H2O
(1)与Ar核外电子排布相同的离子S2― 、Cl― 、K+ ;对于电子层结构相同的离子,核电荷数越大,离子半径越小,S2― >Cl― >K+ 。能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,有NaF和AlN,但该物质的水溶液显碱性,只有NaF,因为F― 水解显碱性。水解的离子方程式:F― +H2O  HF +OH― 。
HF +OH― 。
(1)f:Si、g:S 非金属性强弱看最高价氧化物对应水化物的酸性;与氢化合的难易。选BD
