现有五种短周期主族元素A、B、C、 D、E,其原子序数依次增大。A原子约占宇宙中原子总数的88.6%,A+又称为质子:B是形成化合物种类最多的元素,C元素的最简单的氢化物Y的水溶液显碱性.E是短周期元素中电负性最小的元素。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题:
(1)写出A、E两元素形成的原子个数比为1:1的化合物的电子式____。
(2)向氯化亚铁溶液滴加过量的E的最高价氧化物对应水化物的溶液,现象是____。
(3)Y溶液显碱性的原因是(用一个离子方程式表示)____。
(4)检验汽车尾气中含有的化合物BD的方法是:向酸性PdC12溶液中通A汽车尾气,若生成黑色沉淀(Pd),证明汽车尾气中含有BD。写出反应的离子方程式____。
(5)下列有关物质性质的比较中.不正确的是 。
a.热稳定性:H2S>SiH4 b.离子半径:Na+>S2-
c.第一电离能N>O d.元素电负性:C>H
(6)已知:①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0kJ/mol
②CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol
由上述方程式可知.CH3OH的燃烧热____(填“大于”、“等于”或小于”)192.9kJ/mol。已知水的气化热为44 kJ/mol.则表示氢气燃烧热的热化学方程式为____。
(14分,每空2分)
(1)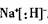
(2)先有白色沉淀,迅速变为灰绿色,最后变成红褐色
(3)NH3+H2O NH4++OH-
NH4++OH-
(4)CO+PdCl2+H2O=Pd+CO2+2H++2Cl-
(5)b
(6)大于;H2(g)+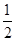 O2(g)=H2O(l) ΔH=-124.6KJ/mol
O2(g)=H2O(l) ΔH=-124.6KJ/mol
题目分析:根据题意可以推知A、B、C、D、E分别为H、C、N、O、Na;
(1)Na与H形成离子型化合物
(2)二价铁易氧化,与NaoH结合后,生成白色氢氧化亚铁,逐渐氧化成氢氧化铁;
(3)一水合氨电离方程式
(4)氧化还原反应方程式书写,先判断反应物和生成物,然后配平;
(5)元素周期律可知,非金属性越强,气态氢化物温度性越强,a正确;电子层数越多,半径越大,故S2->Na+,b错误;N为半充满,第一电离能大于O,c正确;非金属性越强,电负性越大,d正确;
(6)由②反应和水从气态到液态放热可知,CH3OH的燃烧热大于192.9KJ;由盖斯定律可知,氢气的燃烧热,并写出热化学方程式。
