下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用相应化学用语回答下列问题:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
(2)④⑤⑧形成的简单离子半径由大到小的顺序为_______________(填离子符号);③⑦⑨的最高价氧化物对应水化物的酸性由强到弱的顺序为____(填化学式)。
(3)⑤和⑨形成化合物的晶体类型为__________。
(4)这些元素形成的氧化物中,不溶于水,但既能与强酸又能与强碱反应的是___________(填化学式),写出它与⑤的最高价氧化物对应水化物发生反应的离子方程式__________。
(5)X、Y由①②④中的两种或三种元素组成。X的溶液能与小苏打反应产生Y,若X是其所属系列中最简单的分子,且相对分子质量为46,则X的名称为 ,写出X溶液与小苏打反应的化学方程式为_______________。
(1) (1分);
(1分);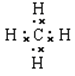 (1分);
(1分);
 (1分);
(1分);
(2)S2->O2->Na+(1分);HClO4>HNO3>H2SiO3(1分) (3)离子晶体(1分)
(4)Al2O3(1分) ;Al2O3+2OH-=2AlO- 2+H2O(2分)
(5)甲酸(1分);HCOOH+NaHCO3= HCOONa +CO2↑+H2O(2分)
题目分析:根据元素①~⑨在表中的位置可知,它们分别是H、C、N、O、Na、Al、Si、S、Cl。
(1)形成化合物种类最多元素是碳元素,碳元素的原子序数是6,其原子结构示意图为 ;原子半径最小的是氢元素,因此它与原子半径最小的原子形成10电子且为正四面体结构的化合物是甲烷,其电子式为
;原子半径最小的是氢元素,因此它与原子半径最小的原子形成10电子且为正四面体结构的化合物是甲烷,其电子式为 ;⑤和⑧形成化合物是硫化钠,含有离子键的离子化合物,其形成过程可表示为
;⑤和⑧形成化合物是硫化钠,含有离子键的离子化合物,其形成过程可表示为 。
。
(2)④⑤⑧形成的简单离子分别是O2-、Na+、S2-,离子的核外电子层数越多离子半径越大。核外电子排布相同的微粒其离子半径随原子序数的增大而减小,所以④⑤⑧形成的简单离子半径由大到小的顺序是S2->O2->Na+。非金属性越强,最高价氧化物对应水化物的酸性越强,③⑦⑨三种元素的非金属性强弱顺序是Cl>N>Si,其最高价氧化物对应水化物的酸性由强到弱的顺序为HClO4>HNO3>H2SiO3。
(3)⑤和⑨形成化合物是NaCl,其晶体类型为离子晶体。
(4)不溶于水,但既能与强酸又能与强碱反应的是Al2O3。钠的最高价氧化物对应水化物是氢氧化钠,和氧化铝反应的离子方程式为Al2O3+2OH-=2AlO- 2+H2O。
(5)X的溶液能与小苏打反应产生Y,这说明X的酸性强于碳酸的。又因为X是由H、C、O元组成,如果X是其所属系列中最简单的分子,且相对分子质量为46,则X一定是甲酸,与碳酸氢纳反应的化学方程式为HCOOH+NaHCO3= HCOONa +CO2↑+H2O。
