短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子。试回答下列问题:
(1)比较第一电离能:Z W(填“>”、“<”或“=”,后同);电负性:X Y。
(2)写出Q的价电子排布图 ,YF3的结构式 。
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:
_________________________ 。
(1)>; <; (2) ;
; 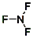 ;
;
(3)Cu2++2NH3·H2O = Cu(OH)2↓+2NH4+;
Cu(OH)2+4NH3 = [Cu(NH3)4]2++2OH- (或Cu(OH)2+4NH3·H2O = [Cu(NH3)4]2++2OH-+4H2O)
题目分析:短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X原子核外最外层电子数是次外层的2倍,由于最外层电子数不能超过8个,则X原子有2个电子层,最外层电子数为4,即X为碳元素;Z、W是常见金属,原子序数大于碳元素,因此是第三周期元素。Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,则W为Al元素、Z为Mg元素;Y的氟化物YF3分子中各原子均达到8电子稳定结构,因此Y为非金属,则Y表现+3价,最外层电子数为8-3=5,处于ⅤA族,原子序数小于Mg元素,则Y为氮元素;Q处于第三周期,p能级上有一个未成对电子,外围电子排布为3s23p1或3s23p5,由于W为Al元素,则Q为Cl元素。
(1)金属性越弱,第一电离能越大。但由于Mg原子3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能比Al元素的高;同周期自左而右电负性逐渐增大,故电负性C<N,。
(2)Q为Cl元素,外围电子排布为3s23p5,所以氯元素的价电子排布图为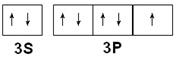 。NF3中氮原子与氟原子之间形成1对共用电子对,所以结构式为:
。NF3中氮原子与氟原子之间形成1对共用电子对,所以结构式为: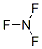 。
。
(3)向硫酸铜溶液中逐滴滴入氨水溶液至过量,先生成氢氧化铜与硫酸铵,有蓝色沉淀生成。继续滴加过量的氨水,氢氧化铜与氨水反应生成四氨合铜络离子,蓝色沉淀消失,溶液呈深蓝色,反应离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+或Cu(OH)2+4NH3·H2O = [Cu(NH3)4]2++2OH-+4H2O。

