某校研究性学习小组用下图装置进行镁条在空气中燃烧的实验,燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶容积的70%。
(1)下图中A仪器的名称是______,燃烧、冷却后打开止水夹,水能进入集气瓶中的原因是:__________。
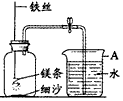
(2)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_____%。现进入集气瓶中水的体积约为其容积的70%,根据空气的组成可推出减少的气体中有氮气。
【发现问题】氮气是怎么减少的呢?
【假设一】氮气与镁条反应而减少。
【假设二】________________________________。
【查阅资料】镁条在氮气中燃烧,生成氮化镁(Mg3N2)固体,反应的方程式为:__________, 反应类型为_________,其中氮化镁中氮的化合价是___________。镁条还可以在二氧化碳中燃烧生成碳和氧化镁,反应的方程式为__________,该反应的类型是__________。
(3)通过以上探究,你对燃烧的有关知识有了什么新的认识:__________、_________。(请写出两点)。
(4)小芳为测定Vc药片中维生素C(化学式为C6H8O6)的质量分数,进行了如下实验:取Vc药片2g,共消耗I2的质量为2.54g。请你帮助小芳计算该Vc药片中维生素C的质量分数。(反应原理:C6H8O6+I2=C6H6O6+
2HI )
(1)烧杯;集气瓶中气体减少,压强减小,导致烧杯中的水进入集气瓶
(2)21
【假设二】氮气(在高温条件下)与瓶内的其他物质反应而减少(合理即可);
3Mg+N2 Mg3N2;化合反应;-3;2Mg+CO2
Mg3N2;化合反应;-3;2Mg+CO2 2MgO+C;置换反应
2MgO+C;置换反应
(3)燃烧不一定需要氧气(或燃烧也可以是置换反应;二氧化碳不但能灭火,在一定条件下还能支持燃烧等。(其他合理答案均给分)
(4)解:设2gVc药片中维生素C的质量为x
C6H8O6+I2==C6H6O6+2HI
176 254
x 2.54g
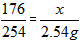
x=1.76g
Vc药片中维生素C的质量分数为: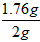 ×100%=88%
×100%=88%
