短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。
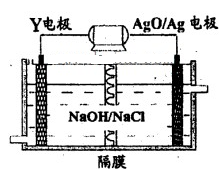
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
(1)第3周期第ⅢA族
(2)酸 NH4+ + H2O = NH3•H2O + H+
(3)Al + 4OH- -3e- = AlO2- + 2H2O
(4)Si b c d
题目分析:短周期元素X、Y、Z、W原子序数依次增大,X氢化物的水溶液显碱性,则X是N元素;Y在元素周期表中所处的周期序数与族序数相等,且Y的原子序数大于X,所以Y是Al元素;Z单质是将太阳能转化为电能的常用材料,则Z是Si元素;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中,则W是Cl元素,
(1)Y是Al元素,铝原子核外有3个电子层,最外层有3个电子,所以在元素周期表中位于第三周期第IIIA族,X的氢化物是氨气,其电子式为: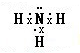 ;
;
(2)氨水和盐酸恰好反应时生成氯化铵,氯化铵是强酸弱碱盐,铵根离子水解导致溶液中氢离子浓度大于氢氧根离子浓度而使其水溶液呈酸性;
(3)该装置是原电池,铝作负极,负极上铝失电子发生氧化反应,电极反应式为:
Al+4OH--3e-=AlO2-+2H2O,
(4)硅的非金属性小于氯元素,比较非金属强弱的方法有:其最高价含氧酸的酸性强弱、吸引电子的能力等;
