问题
问答题
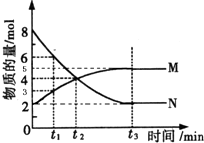
在一定温度下,4L密闭容器内存在反应2N═M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
(1)比较t2时刻,正逆反应速率大小V正______V逆.
(2)若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:______.
(3)t1与t2相比,反应速率______较慢,其原因是______;已知该反应是放热反应,则N的能量______M的能量 填(“大于”、“小于”、“等于”)
答案
(1)t2到t3时刻,M的物质的量继续增加,N的物质的量继续减小,t2时刻反应未达平衡,反应向正反应方向进行,
V正>V逆,
故答案为:>
(2)由图象可知,用M表示的平均化学反应速率为v=
=△c △t
=0.5mol/(L•min),(4-2)mol 2L 2min
故答案为:0.5mol/(L•min)
(3)由图象可知,t1时刻反应物的物质的量比t2时刻大,体积为定值,所以,t2时刻反应物浓度降低.浓度越大反应速率越大,t1与t2相比,反应速率t2较慢;
根据能量守恒,反应物的总能量>生产物的总能量,放热反应;反应物的总能量<生产物的总能量,吸热反应;
该反应是放热反应,所以N的总能量 大于M的总能量
故答案为:t2;反应物浓度降低; 大于

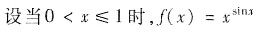 ,对于其它的x,f(x)满足f(x)+k=2f(x+1),求常数k的值,使f(x)在x=0处连续.
,对于其它的x,f(x)满足f(x)+k=2f(x+1),求常数k的值,使f(x)在x=0处连续.