已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素,D3B中阴、阳离子具有相同的电子层结构,B、C均可分别与A形成10个电子分子,B、C属同一周期,两者可以形成许多种共价化合物,C、F属同一主族,B原子最外电子层的p能级上的电子处于半满状态,C的最外层电子数是内层电子数的3倍,E最外层电子数比最内层多1。请用具体的元素回答下列问题:
(1)E元素原子基态电子排布式 。
(2)用电子排布图表示F元素原子的价电子构型 。
(3)F、G元素对应的最高价含氧酸中酸性较强的分子式为 。
(4)离子半径D+ B3—,第一电离能B C,电负性C F
(填“<”、“>”或“=”)。
(5)A、C形成的一种绿色氧化剂X有广泛应用,X分子中A、C原子个数比1∶1,X的电子式为 ,试写出Cu、稀H2SO4与X反应制备硫酸铜的离子方程式 。
(6)写出E与D的最高价氧化物对应的水化物反应的化学方程式 。
(1)1s22s22p63s23p1(2分)
(2)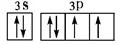 (2分)
(2分)
(3)HClO4(2分)
(4)<(1分) > (1分) >(1分)
(5)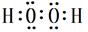 (2分) Cu+2H++H2O2=Cu2++2H2O(2分)
(2分) Cu+2H++H2O2=Cu2++2H2O(2分)
(6)2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2分)
题目分析:A是周期表中原子半径最小的元素,是H,B是N,C是O,D是Na,E是Al,F是S,G是Cl,(1)E元素原子基态电子排布式1s22s22p63s23p1,答案:1s22s22p63s23p1;(2)用电子排布图表示F元素即S元素原子的价电子构型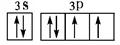 ,答案:
,答案: ;⑶F 、G元素对应的最高价含氧酸H2SO4、HClO4中酸性较强的分子式为HClO4,答案:HClO4;⑷电子层结构相同的离子,原子序数越大半径越小,Na+<N3―,第一电离能N>O,同主族从上到下,电负性减弱,电负性,O>S。答案;<、>、>;⑸H、O形成的H2O2 的电子式:
;⑶F 、G元素对应的最高价含氧酸H2SO4、HClO4中酸性较强的分子式为HClO4,答案:HClO4;⑷电子层结构相同的离子,原子序数越大半径越小,Na+<N3―,第一电离能N>O,同主族从上到下,电负性减弱,电负性,O>S。答案;<、>、>;⑸H、O形成的H2O2 的电子式: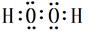 ;Cu、稀H2SO4与H2O2反应制备硫酸铜的离子方程式 Cu+2H++H2O2=Cu2++2H2O;答案;
;Cu、稀H2SO4与H2O2反应制备硫酸铜的离子方程式 Cu+2H++H2O2=Cu2++2H2O;答案; 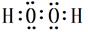 Cu+2H++H2O2=Cu2++2H2O;⑹E是Al,与NaOH反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
Cu+2H++H2O2=Cu2++2H2O;⑹E是Al,与NaOH反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
