有A、B、C、D、E、五种常见的短周期元素,它们的原子序数依次增大,其中C元素原子最外层电子数是次外层电子数的3倍,B元素原子的最外层电子数比C元素原子的最外层电子数少1个;A和D,C和E同主族,又知C、E两原子序数之和是A、D两原子序数之和的2倍。请回答下列问题:
(1)写出由A、C、D三种元素形成的化合物的电子式 ,该化合物的化学键类型为 。
(2)D2E溶液呈 (填“碱性”、“酸性”、“中性”),试用离子方程式解释原因 。
(3)0.5 L 0.1mol·L—1D的最高价氧化物的水化物与0.25L 0.1 mol·L—1E的最高价氧化物的水化物反应放出2865J的热量,该反应的热化学方程式为: 。
(4)由B的氢化物与C的单质、KOH溶液构成原电池,负极产生B的单质。则其负极电极反应方程式为 。
(1) 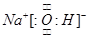 ;离子键、极性共价键
;离子键、极性共价键
(2)碱性 S2-+H2O SH-+OH-
SH-+OH-
(3)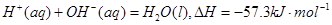
(4)2NH3-6e-+ 6OH- =N2+6H2O
题目分析:由C元素原子最外层电子数是次外层电子数的3倍,可以推断C为O,从而知B为N,E为S,C、E两原子序数之和是A、D两原子序数之和的2倍,可以推断出A为H,D为Na。(2)Na2S溶液呈碱性,多元弱碱阳离子水解逐级水解,S2-+H2O SH-+OH-,(3)0.05mol的NaOH和0.025mol的H2SO4反应放出热量2865焦,生成0.05摩尔水,根据物质的量与焓变成正比,可以计算出生成1摩尔水放出热量57.3KJ,(4)氨气在负极失电子发生氧化反应,根据电荷守恒和原子守恒可以写出电极反应式2NH3-6e-+ 6OH- =N2+6H2O
SH-+OH-,(3)0.05mol的NaOH和0.025mol的H2SO4反应放出热量2865焦,生成0.05摩尔水,根据物质的量与焓变成正比,可以计算出生成1摩尔水放出热量57.3KJ,(4)氨气在负极失电子发生氧化反应,根据电荷守恒和原子守恒可以写出电极反应式2NH3-6e-+ 6OH- =N2+6H2O
