下图是元素周期表的框架
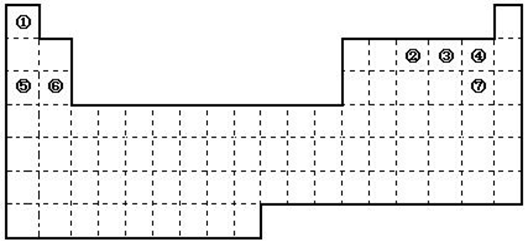
(1)依据元素周期表回答下列问题:
①.周期表中的元素⑤和元素⑥的最高价氧化物的水化物碱性强弱顺序是
(用化学式表示);
②.周期表中的元素④和元素⑦的氢化物的熔、沸点高低顺序是 (用化学式表示);
③.在上面元素周期表中全部是金属元素的主族是 ;全部是非金属元素的主族是 (填写字母a、b、c、d);
a.ⅠA族 b.ⅡA族 c.ⅥA 族 d.ⅦA族
(2)已知甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,请写出甲的氧化物与NaOH溶液反应的离子方程式 。
(1)①NaOH>Mg(OH)2(2分)②HF>HCl(2分) ③ b ,d (每空1分,2分)
(2)Al2O3 + 2OH-= 2AlO2-+ H2O (2分)
题目分析:(1)①根据元素周期表中的位置可知⑤为Na、⑥为Mg,则最高价氧化物的水化物碱性强弱顺序是NaOH>Mg(OH)2。
②周期表中的元素④为F、元素⑦为Cl,HF分子间形成了氢键,所以沸点:HF>HCl。
③ⅡA族中元素全是金属,ⅦA族中元素全是非金属。
(2)甲元素位于第三周期,且其原子半径为同周期金属元素中原子半径最小的,则甲为Al元素,Al2O3与NaOH溶液反应的离子方程式为:Al2O3 + 2OH-= 2AlO2-+ H2O。
