现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B,C形成电子总数为10的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数为18的气体分子。请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关);
(1)A~F六种元素原子,原子半径最大的是 (填元素符号),B元素在元素周期表中的位置 。
(2)D与E可形成化合物D2E,该化合物的电子式为 。
(3)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与碳反应,该反应的化学方程式为 ________________________________。
(4)比较E、F气态氢化物的稳定性: > (用分子式表示)。
(5)请写出:CH3OH和O2与KOH溶液组成的燃料电池总反应式: 。
(1)Na 1分 第二周期VA族 2分
(2)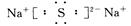
(3)Cu +2H2SO4(浓)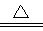 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)HCl>H2S
(5)2CH3OH+3O2+4OH-=2CO32-+6H2O
题目分析:由A、C形成的化合物常温下为液态,猜测其为H2O,A是H,C 是O,故B是N,E是S,D是Na ,F 是Cl。
(1)原子半径最大的是钠,N元素在元素周期表中的位置是第二周期VA族。
(2)D(Na)与E(S)可形成化合物为Na2S,电子式为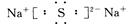 ,属于离子晶体。
,属于离子晶体。
(3)A(H)、C(O)、E(S)三种元素形成的一种常见化合物,其浓溶液是浓硫酸。所以与铜的化学方程式是Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)E(S)、F(Cl)气态氢化物分别是H2S、HCl,同一周期,气态氢化物的稳定性逐渐增强,所以HCl>H2S。
(5)CH3OH和O2反应的化学方程式是: 2CH3OH+3O2=2CO2+4H2O ① 电解质溶液为KOH溶液,CH3OH反应生成的CO2会和KOH反应,CO2+2KOH=K2CO3+H2O ②
①+②×2,得:甲醇燃料电池的总化学反应为:2CH3OH+3O2+4KOH=6H2O+2K2CO3
总离子反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O
