X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z | Z元素的最高正价与负价代数和为6 |
| W | W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的 键数目为 。
键数目为 。
(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ•mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ•mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。
(1)4 (1分) VIB(1分) 1 (1分)
(2)小(2分) 2NA(2分)
(3)H2O(2分) H2S(2分)
(4)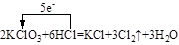 (3分)
(3分)
(5)C(s)+1/2O2=CO(g) ΔH=" -110.6" kJ•mol-1(2分)
题目分析:由Y的基态原子最外层电子排布式nsnnpn+2,可知Y为O;则由X原子基态时最外层电子数是其内层电子总数的2倍,可知X为C;Z元素的最高正价与负价代数和为6,可知Z为Cl;W基态原子未成对电子数是前30号元素中最多的,则W为Cr。
(1)Cr位于第4周期VIB族,最外层有1个电子。
(2)C的第一电离能比O小;C22-中含有1个碳碳三键,则1mol X22-中含有的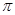 键数目为2NA。
键数目为2NA。
(3)因为O元素的非金属性大于C,所以X和Y的气态氢化物中,较稳定的是H2O;H2O分子间含有氢键,H2O的沸点最高,其它同族氢化物分子间为范德华力,随相对分子质量的增加而增大,所以最简单氢化物中沸点最低的是H2S。
(4)KClO3与HCl反应生成KCl、Cl2、H2O,配平可得化学方程式,根据化合价的变化,KClO3中Cl元素由+5价降低为0价,可标出电子转移的方向和数目。
(5)首先写出化学方程式并注明状态,然后根据盖斯定律,∆H=ΔH 1-ΔH 2="-110.6" kJ•mol-1,进而写出热化学方程式。
