短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等。
| Q | R | ||
| T | W |
(1)T的原子结构示意图是______。用化学方程式表示工业常用冶炼T单质的原理是______。
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子中存在的共 价键的类型是______。
(3)元素的非金属性:Q______W(填“强于”或“弱于”),结合方程式简述其原因是______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物,实验步骤:将盛有甲的试管倒扣在水槽中,______。
(1)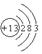 2Al2O3
2Al2O3 4Al+3O2↑
4Al+3O2↑
(2)极性键和非极性键
(3)弱于 CO32—+H2O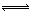 HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解
HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解
(4)向试管中缓缓通入足量氧气
题目分析:由短周期元素及图可知,则Q、R在第二周期,T所处的周期序数与主族序数相等,则T在第三周期第ⅢA族,即T为Al,依次推出Q为C,R为N,W为S。
(1)T为Al,原子结构中有3个电子层,最外层电子数为3,原子结构示意图为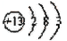
(2)与W同主族的某元素,其氢化物分子中含有18个电子,该分子为H2O2,该分子存在的化学键类型为:极性键和非极性键。
(3)根据Na2CO3溶液显酸性,Na2SO4溶液为中性,碳的非金属性弱于硫的非金属性;CO32‾水解反应离子方程式为:CO32—+H2O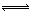 HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解。
HCO3—+OH— ,碳酸根水解,而硫酸根不发生水解。
(4)甲是R的氧化物,通常状况下呈红棕色,为NO2,向试管中缓缓通入足量氧气,发生反应:4NO2+O2+2H2O=4HNO3,可全部转化为HNO3。
