X是一种重要的工业原料, X在160℃分解制备异氰酸和氨气,反应方程式为:X  HCNO + NH3(已配平)。完成下列填空:
HCNO + NH3(已配平)。完成下列填空:
(1)在上述反应所涉及的各元素中,原子半径最大的元素是_________,其原子核外电子共占据_______个轨道。
(2)在上述物质中有三种元素处于同周期,下列叙述中能说明三种元素C,N,O非金属性递变规律的事实是____________。
a.最高价氧化物对应水化物的酸性
b.单质与H2反应的难易程度
c.两两形成化合物中元素的化合价
工业上在催化剂条件下,用NH3作为还原剂将烟气中的NOx还原成无害的氮和水,反应方程式可表示为:
2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=__________mol/L·min。
(4)当该反应达到平衡时,下列说法一定错误的是___________。
a.气体密度不变 b.气体颜色不变
c.υ(NO)正= 2υ(N2)逆 d.N2和NH3的浓度相等
(5)X可以代替NH3还原烟气中的NOx,X的分子模型如图所示,X电子式为______________。

(6)氰酸有两种结构,一种分子内含有叁键,称为氰酸,另一种分子内不含叁键,称为异氰酸,且两种结构中所有原子最外层均已达到稳定结构,分子中也不含环状结构。请分别写出氰酸和异氰酸的结构式:_______________、______________。
(1)C(1分),4个(1分)
(2)c(2分)
(3)0.005mol/(L·min) (2分)
(4)c(2分)
(5)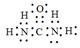 (2分)
(2分)
(6)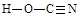
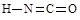 (2分)
(2分)
题目分析:根据X  HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
HCNO + NH3(已配平)反应,可知X中含有C,H,O,N元素。
(1)各元素中,原子半径最大的元素是碳,其原子核外电子共占据4个轨道分别是1S22S22P2,其中S轨道2个,P轨道2个。
(2)元素非金属性递变规律的事实可能通过c.两两形成化合物中元素的化合价来判断,由于氧元素没最高价氧化物对应水化物,故也无法通过单质与H2反应的难易程度来判断。正确答案为bc。2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)
2N2(g)+3H2O(g)
(3)一定条件下该反应在容积为2L的容器内反应,20 min时达到平衡,生成N2 0.4 mol,则平均反应速率υ(NO)=0.4/(2*20)*2="_0.005mol/(L·min)" 。
(4)a.气体密度始终不变,不能做为判断依据。b.气体颜色不变即浓度不变,正确。c.υ(NO)正= 2υ(N2)逆比值关系错误,错误。d.N2和NH3的浓度相等不一定平衡,正确。故选C。
(5)X电子式为 。
。
(6)根据信息氰酸和异氰酸的结构式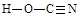
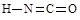 。
。
