阅读理解,回答问题。
喜欢废铁的沈老汉
⑴沈老汉守在收购点门外,远远地看见一个穿着破衣服的男子骑一辆旧三轮车过来,他满面笑容地迎了上去……
⑵沈老汉五十多岁,已是白发白须,一脸的憔悴。沈老汉有个独予阿将,35岁了,还没有媳妇儿。阿将处过几个女友,女方总嫌他家贫穷。沈老汉为了挣钱帮儿子娶上媳妇儿,东借西凑一笔资金,办了一家废铁收购点。
⑶沈老汉给那个男子递了一支烟,倒了一杯茶。男子叫火强,以前也卖给沈老汉废铁。火强说:“老头儿,你怎么看上去像我们外地人一样?”沈老汉笑笑说:“外地人怎么了?与本地人一样啊,都是中国公民。”火强弯腰开始从三轮车内搬废铁,沈老汉过去帮忙。火强一看慌乱起来,忙挡住沈老汉说:“这点小事,怎么能劳大叔出力?”火强见沈老汉没有坚持,向那些废铁望了一眼,松了一口气。如果沈老汉过去搬废铁,秘密一定会被发现——在两根粗铁管里,塞满了泥沙。
⑷称完废铁,没经沈老汉验收,火强快手快脚地把废铁倒入场地的铁堆里。沈老汉笑呵呵地说:“年轻人,辛苦了。”火强偷偷地笑着想,沈老汉真是个糊涂蛋!
⑸阿将回来,他一眼便在铁堆里发现了问题——新收的两根废铁管里塞满了泥沙。阿将瞧着沈老汉说:“爸,你怎么这样收废铁啊?泥沙当废铁,我们亏损不起啊。”沈老汉说:“放心,我们没亏。”阿将瞪着沈老汉。沈老汉继续说:“我收购的时候,就发现了这事,本想揭露出来,怕他丢了丑,今后不来做生意。最后我也用了一个雕虫小技。”阿将用疑惑的眼光望着沈老汉,沈老汉说:“过秤时,我换了秤砣,把那四十多斤泥沙扣除了。”
⑹沈老汉的生意逐步走上正轨。沈老汉对待卖废铁的顾客总是满面笑容,有时笑得像个孩子一样。可是对来卖好铁、新铁的顾客,沈老汉总是眉头紧锁,一脸不悦,好像人家欠他什么似的。一次,老张送来一车铁,沈老汉笑呵呵地把废铁收了,却对好铁不屑一顾。老张火了,说:“沈老头,你脑子有问题,人家千方百计要好铁,你却偏偏喜欢废铁啊。”沈老汉说:“收废铁我晚上睡得着,收好铁新铁晚上睡不着啊。”老张说:“怪人。”摇着头离开了。
⑺一天晚上,火强载来了一三轮车新铁管。沈老汉把头摇得如吊钟一样。火强说:“你真不会做生意,开收购点,不收好铁谁信啊。”沈老汉来回走了几步,还是摇头说:“我不能收。”火强说::‘这些铁管,我也是收来的,挣点小钱。我从来没做过偷鸡摸狗的勾当.,”沈老汉又摇了一下头,火强火了,说:“如果这次你不收,今后我不会卖铁给你,还会叫我的老乡与你断绝业务。”沈老汉全身一颤抖。后来沈老汉颤抖着手收购了火强的好铁管。
⑻沈老汉为人诚实,价格公道,远远近近的拾荒者、小贩总喜欢把废铁卖给沈老汉。沈老汉的生意渐渐旺了起来。
⑼那天,沈老汉出事了。片警传唤沈老汉进了派出所。原来火强卖的那些新铁管是赃物。火强坐了牢,沈老汉也被行政拘留了10天。
⑽沈老汉进去后,阿将打听来打听去,终于弄明白那事是被人举报的,不然公安人员怎么会查到他们头上啊。
⑾阿将想来想去——自己家没有仇人啊,谁会是举报人呢?阿将找片警几次,想知道举报人是谁。片警说,你想砸我饭碗?别说举报人我不认识,就是知道,也不会告诉你的。
⑿沈老汉放出来后,大家很同情沈老汉,说他被贼害苦了。新老顾客都来关照收购点的生意,收购点红火起来。
⒀阿将却念念不忘查出那个举报人。他每天关注收购点进进出出的行人,可是观察了很长一段时间,就是没有发现可疑人员。那天,沈老汉去了外面,搁在桌子上的手机响了。阿将一听,吓了一跳,来电人自称是派出所的民警,请他去派出所领荣誉证书和举报奖金。他更糊涂了,问,举报什么?民警说,一起收赃案啊,让我们破了系列盗窃案件。
⒁阿将的头疼痛起来,想了很久也不明白,爸怎么会举报自己收购赃物。
1、文章第⑵段从记叙顺序来看是____叙。这段文字有什么作用?
____________________________________________________________________________
2、下列有关本文的表述不正确的一项是 ( )
A.从第⑷段的“快手快脚”“偷偷地笑”等词语中可看出火强是一个贪图小便宜且自作聪明的人。
B.俗话说“无商不 * * ”。沈老汉通过偷偷换秤砣的方法收购火强塞满泥沙的铁管,由此可见他也是一个弄虚作假、贪图小利的 * * 商。
C.沈老汉的生意渐渐好起来主要是因为他为人诚实,价格公道。
D.“收废铁我晚上睡得着,收好铁新铁晚上睡不着啊。”这句话的言外之意是:沈老汉担心好铁新铁是赃物,如果收购了,会给自己带来麻烦。
3、这篇小说情节曲折生动,请根据故事发展的脉络补充完整下面的情节。(每处填四字)
(1)智胜火强
(2)________
(3)________
(4)案发被拘
(5)________
4、第⑺段两个加点的“颤抖”分别表现了沈老汉怎样的心理?
__________________________________________________________________________
5、沈老汉为什么举报自己?读完全文,你认为沈老汉是个怎样的人?
__________________________________________________________________________
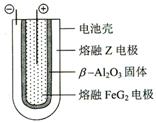
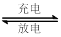 Fe + 2ZG
Fe + 2ZG 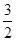 O2(g)=H2O(l)+SO2(g) ΔH=-a kJ·mol-1
O2(g)=H2O(l)+SO2(g) ΔH=-a kJ·mol-1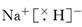 NaH+H2O=NaOH+H2↑ (5) Fe2++2e-=Fe 钠 β-Al2O3
NaH+H2O=NaOH+H2↑ (5) Fe2++2e-=Fe 钠 β-Al2O3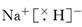 .它与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑。(5)放电时Fe为负极,负极的电极反应为Fe-2e-=Fe2+.C棒为正极。在正极上发生反应Fe2++2e-=Fe。充电时钠与电源的负极相连,在该电极上发生反应Na++e-=Na。该电池的电解质为β-Al2O3。
.它与水反应放出气体的化学方程式为:NaH+H2O=NaOH+H2↑。(5)放电时Fe为负极,负极的电极反应为Fe-2e-=Fe2+.C棒为正极。在正极上发生反应Fe2++2e-=Fe。充电时钠与电源的负极相连,在该电极上发生反应Na++e-=Na。该电池的电解质为β-Al2O3。