X、Y、Z、W是原子序数依次增大的四种短周期元素。X与W可形成四面体形的共价化合物,该化合物常用作灭火剂。Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y、Z的最外层电子数之和等于W的最外层电子数。
(1)用化学符号表示X的一种核素 。
(2)写出Y的单质与X的最高价氧化物反应的化学方程式 。
(3)Z的单质在W的单质中燃烧,生成的产物中各原子的最外层均达到8电子稳定结构的分子为 。
(4)用电子式表示Y与W形成化合物的过程为 。
(5)XW4的电子式为 。
(6)W的氢化物R是实验室一种常用试剂的主要成分,该试剂可用于实验室多种气体的制备,写出实验室制取气体时满足下列条件的离子方程式。
①R作氧化剂: 。
②R作还原剂: 。
(1)126C或136C或146C或12C或13C或14C
(2)2Mg+CO2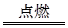 2MgO+C
2MgO+C
(3)PCl3
(4) 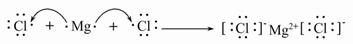
(5)
(6)①2H++Zn=Zn2++H2↑
②MnO2+4H++2Cl- Mn2++Cl2↑+2H2O(其他合理答案均可)
Mn2++Cl2↑+2H2O(其他合理答案均可)
Y的次外层电子数等于其最外层和最内层电子数之和的2倍,Y为Mg;X与W形成四面体形的化合物,该化合物可用作灭火剂,且X的原子序数比Mg小,W的原子序数比Mg大,可知X与W形成的化合物为CCl4,X为C,W为Cl。Mg与Z的最外层电子数之和与Cl的最外层电子数相等,可知Z为P。
(1)C元素的核素可能有126C或136C或146C。
(2)Mg在CO2中燃烧的化学方程式为2Mg+CO2 2MgO+C。
2MgO+C。
(3)P在Cl2中燃烧,可形成PCl3和PCl5,其中PCl3中各原子的最外层均达到8电子稳定结构。
(4)MgCl2的形成过程为: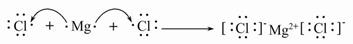
(5)CCl4的电子式为:
(6)HCl作氧化剂的离子方程式为Zn+2H+=Zn2++H2↑,HCl作还原剂的离子方程式为:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
