I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,X、Y在周期表中相对位置如下图。
| X | ||
| Y |
(1)X在周期表中的位置是________。
(2)Z单质与石灰乳反应的化学方程式为________。
(3)Y的气态氢化物通入FeCl3溶液中,有Y单质析出,该反应的离子方程式为___。
(4)W-Y高能电池是一种新型电池,它以熔融的W、Y单质为两极,两极之间通过固体电解质传递W+离子。电池反应为:16W(l)+nY8(l) 8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
8W2Yn(l)。放电时,W+离子向___极移动;正极的电极反应式为________。
II.在容积可变的密闭容器中充入A、B、C三种气体,发生反应:x A+yB zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
zC,恒温下,通过压缩容器体积改变压强,分别测得A的平衡浓度如下表:
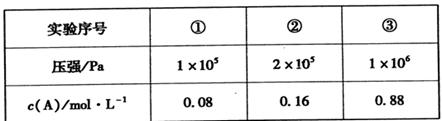
(5)根据①②数据分析得出:x+y ___z(填“>”、“<”或“=”)。
(6)该温度下,当压强为1×106 Pa时,此反应的平衡常数表达式为________。
I.(1)第二周期第ⅣA族;(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)H2S+2Fe3+=2Fe2++2H++S↓;(4)nS8+16e-=8Sn2-;
II.(5)=;(6)K= 。
。
题目分析:I.X、W、Y、Z均为短周期主族元素,原子序数依次增大,X原子的最外层电子数是W的4倍,则根据X、Y在周期表中相对位置可知,X一定是第二周期元素,W、Y、Z均是第三周期元素,其中X是第ⅣA族的碳元素,W是钠元素,Y是硫元素,Z是氯元素。
(1)X在周期表中的位置是第二周期第ⅣA族;
(2)氯气与石灰乳反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)H2S具有还原性,能把铁离子氧化生成单质硫,所以Y的气态氢化物通入FeCl3溶液中,有Y单质析出的离子方程式为H2S+2Fe3+=2Fe2++2H++S↓;
(4)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此放电时,Na+离子向正极移动;正极硫得到电子,电极反应式为nS8+16e-=8Sn2-;
II.(5)根据①②数据分析得出,压强变为原来的2倍时,A的浓度变为原来的2倍,这说明增大压强平衡不移动,因此正方应是体积不变的可逆反应,即x+y=z;
(6)由②③数据可知,压强变为原来的5倍时A的浓度大于原来的5倍,这说明增大压强平衡向逆反应方向移动,即正方应是体积增大的可逆反应。所以此时B不再是气态,因此该温度下反应的平衡常数表达式为K= 。
。
