元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对照中学化学常见长式元素周期表,回答下列问题:
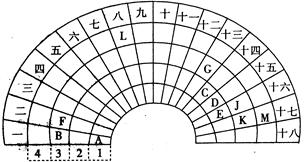
(1)元素C的最高价氧化物的电子式为 ;元素G的离子结构示意图为 。
(2)元素L位于周期表的第 族, 1mol/L LM2溶液500ml与0.4 mol K单质恰好完全反应的离子方程式为_______________________________________。
(3)化合物X是由B、E、G三种元素组成,其水溶液呈_______性,原因是___________
_____________________________________________________(用离子方程式表示)
(4)D和G组成的化合物GD,被大量用于制造电子元件。工业上用G的氧化物、C单质和D单质在高温下制备GD,其中G的氧化物和C单质的则该反应的化学方程式为 。
(5)制取粗硅的过程中,SiO是反应中间产物,隔绝空气时SiO和NaOH溶液反应(产物之一是硅酸钠)的化学方程式______________________________________________
(1)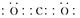
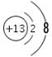
(2)VIII 10Fe2++6Br - +8Cl2=10Fe3++3Br2+16Cl-
(3)碱性,(1分) AlO2-+2H2O 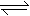 Al(OH)3+OH-
Al(OH)3+OH-
(4)Al2O3+3C+N2  2AlN+3CO
2AlN+3CO
(5) SiO+2NaOH=Na2SiO3+H2↑
题目分析:根据元素周期表中元素的相对位置,推A为氢、B为钠、C为碳、D为氮、E为氧、F为镁、G为铝、J为硫、K为氯、L为铁、M为溴。
(1)元素C的最高价氧化物为二氧化碳,电子式为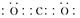 。元素G为铝,Al3+的离子结构示意图为
。元素G为铝,Al3+的离子结构示意图为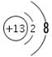 。
。
(1)
(2)元素L为铁,位于周期表的第VIII族 1mol·L-1 LM2(FeBr2)溶液500mL与0.4 mol K单质(Cl2)的物质的量之比为5:4,恰好完全反应,因为还原性:Fe2+> Br-,因此Fe2+先被氧化:2Fe2++ Cl2 Fe3+ + 2Cl-,
Fe3+ + 2Cl-,
每摩尔Fe2+反应用掉0.5molCl2,即按4:2反应,还剩余1.5mol的Cl2与Br-反应:2Br-+ Cl2 Br2 + 2Cl-,
Br2 + 2Cl-,
注意只有3mol的Br-被Cl2氧化了,因为Cl2不足,整理得总反应:10Fe2+ +8Cl2+6Br- 10Fe3+ +16Cl- +3Br2。
10Fe3+ +16Cl- +3Br2。
(3)化合物X是NaAlO2,属于强碱弱酸盐, 水解显碱性,AlO2-+2H2O Al(OH)3+OH-。
Al(OH)3+OH-。
(4)化合物GD是AlN,G的氧化物是Al2O3,C单质是,D单质是氮气,Al2O3与C物质的量之比为1:3,用待定系数法。先假设Al2O3系数为1,C为3,可知AlN为2,N2为1,根据原子守恒,推知还生成3molCO,最后整理得Al2O3+3C+N2  2AlN+3CO。
2AlN+3CO。
(5)SiO和NaOH溶液反应,因为产物之一是酸钠,硅化合价由+2变为+4,化合价有升高,必然有化合价降低,分析可知,只有氢元素化合价可以降低,推出另一产物是氢气,配平得SiO+2NaOH=Na2SiO3+H2↑。
