二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料.它的熔点-80℃,沸点138℃.常温下,它遇水易反应,产生使品红褪色的气体,且溶液出现浑浊.
(1)写出S2Cl2的电子式______,该分子中Cl-S的键长______S-S的键长(填“>”,“<”或“=”).
(2)S2Cl2遇水反应产生气体,该气体分子的空间构型为______,中心原子的杂化轨道类型为______.
(3)HF、H2S、HCl的稳定性由大到小的顺序为______,沸点由高到低的顺序为______.
(4)写出二氯化硫与水反应的化学方程式______.
(1)S2Cl2分子中S原子之间形成1对共用电子对,Cl原子与S原子之间形成1对共用电子对,电子式为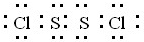 ,
,
S原子半径大于氯原子半径,故Cl-S的键长<S-S的键长;
故答案为: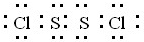 ;<;
;<;
(2)S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,S原子的孤对电子对数=6-2×2 2
=1,价层电子对数=2+1=3,故二氧化硫为V形,S原子产生sp2杂化,
故答案为:V形;sp2;
(3)非金属性F>Cl>S越强,氢化物稳定性HF>HCl>H2S;氟化氢分子之间存在氢键,沸点最高,氯化氢与硫化氢都形成分子晶体,HCl的相对分子质量大,沸点比硫化氢高,故沸点由高到低的顺序为HF>HCl>H2S,
故答案为:HF>HCl>H2S;HF>HCl>H2S;
(4)S2Cl2遇水易水解,并产生能使品红溶液褪色的气体,该气体为二氧化硫,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),由原子守恒可知还生成水,反应方程式为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl,
故答案为:2S2Cl2+2H2O=SO2↑+3S↓+4HCl.
