2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。
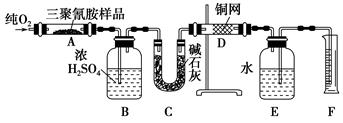
已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成CO2、H2O、N2,实验测得装置B增重0.54 g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____________。
(2)需要加热的装置是____________(填字母代号)。
(3)装置D的作用是_________________________________。
(4)F处读数时应该注意:____________、____________。
(5)三聚氰胺的分子式为_________________。
(1)用来排水,以测定氮气的体积 (2)AD (3)吸收未反应的氧气 (4)量筒内的液面与广口瓶内的液面相平 视线与凹液面最低处相切 (5)C3N6H6
本实验的原理是通过测量三聚氰胺样品燃烧产生的CO2和H2O的质量以及生成的氮气的体积,从而确定各原子的物质的量之比,进而确定分子式。浓硫酸的作用是吸收产生的水蒸气,碱石灰的作用是吸收产生的CO2,因为O2也不溶于水,所以在用排水法收集N2之前应该用热的铜网将O2除净。测量N2的体积时,必须要保证集气瓶中的N2的压强和外界大气压相等。(5)三聚氰胺的物质的量为1.26/126=0.01 mol
n(H2O)=0.54/18=0.03 mol,n(H)=0.06 mol
n(CO2)=1.32/44=0.03 mol,n(C)=0.03 mol
n(N2)=0.672/22.4=0.03 mol,n(N)=0.06 mol
分子式为:C3N6H6。
